
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如图所示:

已知:FeTiO3与盐酸反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是________。
(2)滤渣A的成分是________。
(3)滤液B中TiOCl42—转化生成TiO2的离子方程式是________________。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是________________________________。

(5)反应③的化学方程式是________________________。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)做电极组成电池,其工作原理为Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
(1)+2
(2)SiO2
(3)TiOCl42—+H2O TiO2↓+2H++4Cl-
TiO2↓+2H++4Cl-
(4)温度过高时,反应物氨水(或双氧水)受热易分解
(5)(NH4)2Ti5O15+2LiOH=Li2Ti5O15↓+2NH3·H2O(或2NH3+2H2O)
(6)20?9
(7)LiFePO4-e-=FePO4+Li+
【解析】(2)钛铁矿中只有SiO2不与盐酸反应,因此滤渣A的成分是SiO2。(3)TiOCl42—转化为TiO2,Ti的化合价不变,发生的是TiOCl42—的水解反应。(5)反应③为LiOH与(NH4)2Ti5O15的复分解反应。(6)根据得失电子守恒,可得关系式:2Fe2+~H2O2~2Fe3+~H2C2O4,则17%双氧水与H2C2O4的质量比=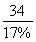 :90=20:9。(7)该电池充电时阳极上LiFePO4发生氧化反应。
:90=20:9。(7)该电池充电时阳极上LiFePO4发生氧化反应。
点拨:本题考查锂离子电池电极材料的制备工艺流程,考查考生对化工流程的综合分析能力。难度较大。


科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学实验基础练习卷(解析版) 题型:选择题
不能用带橡胶塞的玻璃试剂瓶存放的药品是( )
①浓硝酸 ②稀氢氧化钠溶液 ③液溴 ④纯碱溶液 ⑤水玻璃 ⑥氢氟酸
A.①③⑥ B.①④⑥ C.①⑤⑥ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本概念练习卷(解析版) 题型:选择题
在Cu2S+2Cu2O 6Cu+SO2↑反应中,说法正确的是( )
6Cu+SO2↑反应中,说法正确的是( )
A.Cu2O在反应中被氧化
B.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物
D.若反应中转移12 mol电子,则生成6 mol Cu
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)  3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。

下列对W容器中进行的反应推断合理的是( )
A.反应①一定是自发反应,反应②一定是非自发反应
B.若容器内温度保持不变,则v正(B):v逆(C)=2:3
C.若恒压条件下,充入N,则C的物质的量减小
D.升高温度,两个反应的平衡常数都减小
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:

(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。

(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:选择题
化学与社会、生产、生活密切相关。下列说法正确的是( )
A.石英只能用于生产光导纤维
B.从海水中提取物质都必须通过化学反应才能实现、
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 元素及其化合物练习卷(解析版) 题型:选择题
相对分子质量为100的烃,且含有4个甲基的同分异构体共有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第9讲非金属元素化合物练习卷(解析版) 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为_____________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:______________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________________;处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第6讲反应速率和化学平衡练习卷(解析版) 题型:选择题
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
温度/℃ | 15 | 50 | 100 |
化学平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com