
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
| n |
| V |
| 0.002mol |
| 0.025L |
| 1.99g |
| 2.000g |
| 10-14 |
| c(OH-) |
| c3(H+) |
| c(Fe3+) |
| 10-42 |
| c(Fe3+)?c3(OH-) |


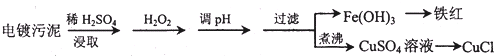
科目:高中化学 来源: 题型:
| A、采用蒸发法从食盐水中提取食盐 |
| B、用结晶法除去硝酸钾中的氯化钠 |
| C、用酒精从溴水中萃取溴 |
| D、用分液法分离汽油和水的混合物 |
查看答案和解析>>
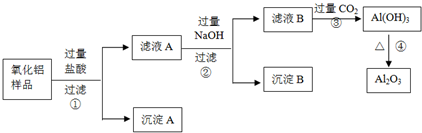
科目:高中化学 来源: 题型:
查看答案和解析>>
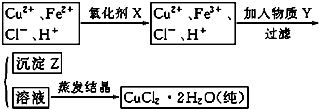
科目:高中化学 来源: 题型:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| B、为了确认实验桌上标明为蔗糖和NaCl的两瓶化学药品中的实物与标签名称是否相符,可各取少量放在口里品尝一下 |
| C、“沙里淘金”利用的是金与沙的密度相差较大 |
| D、实验剩余的药品不要随意丢弃,应放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.NaCl溶液(BaCl2) 加Na2SO4溶液,过滤 |
| B、KNO3溶液(AgNO3) 加NaCl溶液,过滤 |
| C、NaCl固体(Na2CO3) 加HNO3溶液,结晶 |
| D、KNO3溶液(Na2CO3) 加HCl溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
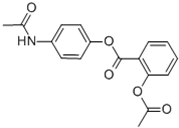 贝诺酯又名朴炎痛、解热安、苯乐安,其结构如图所示,是一种新型抗炎、解热、镇痛药.下列对该化合物叙述正确的是( )
贝诺酯又名朴炎痛、解热安、苯乐安,其结构如图所示,是一种新型抗炎、解热、镇痛药.下列对该化合物叙述正确的是( )| A、贝诺酯分子式为C17H14O5N |
| B、贝诺酯属于芳香烃 |
| C、贝诺酯属于高分子化合物 |
D、已知贝诺酯的水解产物之一为对氨基乙酰酚(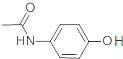 ),在氢核磁共振谱中,对氨基乙酰酚有5种峰 ),在氢核磁共振谱中,对氨基乙酰酚有5种峰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com