
| A、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| B、为了确认实验桌上标明为蔗糖和NaCl的两瓶化学药品中的实物与标签名称是否相符,可各取少量放在口里品尝一下 |
| C、“沙里淘金”利用的是金与沙的密度相差较大 |
| D、实验剩余的药品不要随意丢弃,应放回原瓶 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
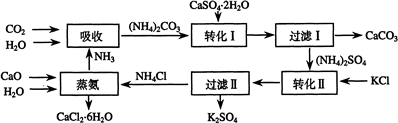
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
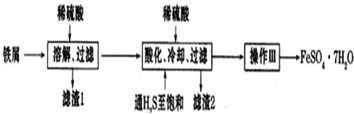
| 25℃ | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS开始沉淀 |
| pH | 3.9 | 1.6 | 3.0 | 5.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
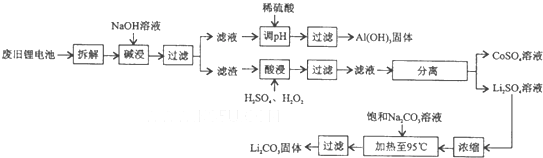
查看答案和解析>>
科目:高中化学 来源: 题型:
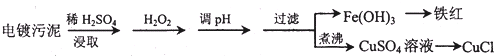
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、SO42-、Cl- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Fe3+、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com