
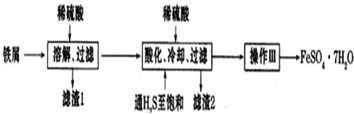
| 25℃ | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS开始沉淀 |
| pH | 3.9 | 1.6 | 3.0 | 5.5 |

| 0.01mol×278g/mol |
| 2.850g |


科目:高中化学 来源: 题型:
| A、甲醛 | B、乙醛 | C、甲酸 | D、甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点 | 沸点 | |
| 碘 | 113.7℃ | 184.3℃ |
| 四氯化碳 | -22.6℃ | 76.8℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
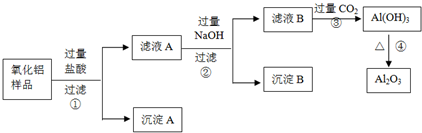
查看答案和解析>>
科目:高中化学 来源: 题型:
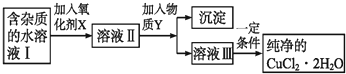
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| B、为了确认实验桌上标明为蔗糖和NaCl的两瓶化学药品中的实物与标签名称是否相符,可各取少量放在口里品尝一下 |
| C、“沙里淘金”利用的是金与沙的密度相差较大 |
| D、实验剩余的药品不要随意丢弃,应放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com