
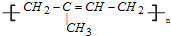 ,天然橡胶是线性结构强度和韧性差,用S和橡胶作用,使橡胶硫化结构由链状变成了网状,让其具有较高的强度、韧性和化学稳定性,线型结构,是一种热塑性塑料,体型结构是一种热固性塑料,
,天然橡胶是线性结构强度和韧性差,用S和橡胶作用,使橡胶硫化结构由链状变成了网状,让其具有较高的强度、韧性和化学稳定性,线型结构,是一种热塑性塑料,体型结构是一种热固性塑料,
| ||
| ||


科目:高中化学 来源: 题型:
| 熔点 | 沸点 | |
| 碘 | 113.7℃ | 184.3℃ |
| 四氯化碳 | -22.6℃ | 76.8℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| B、为了确认实验桌上标明为蔗糖和NaCl的两瓶化学药品中的实物与标签名称是否相符,可各取少量放在口里品尝一下 |
| C、“沙里淘金”利用的是金与沙的密度相差较大 |
| D、实验剩余的药品不要随意丢弃,应放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
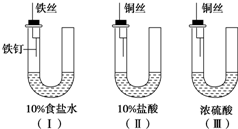 某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )
某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )| A、装置Ⅰ的U形管铁钉一侧的液面一定会上升 |
| B、装置Ⅱ中的铁钉腐蚀最严重 |
| C、比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低 |
| D、装置Ⅲ中的铁钉几乎没有被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
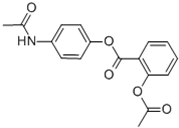 贝诺酯又名朴炎痛、解热安、苯乐安,其结构如图所示,是一种新型抗炎、解热、镇痛药.下列对该化合物叙述正确的是( )
贝诺酯又名朴炎痛、解热安、苯乐安,其结构如图所示,是一种新型抗炎、解热、镇痛药.下列对该化合物叙述正确的是( )| A、贝诺酯分子式为C17H14O5N |
| B、贝诺酯属于芳香烃 |
| C、贝诺酯属于高分子化合物 |
D、已知贝诺酯的水解产物之一为对氨基乙酰酚(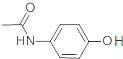 ),在氢核磁共振谱中,对氨基乙酰酚有5种峰 ),在氢核磁共振谱中,对氨基乙酰酚有5种峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com