
| A.澄清石灰水中加入盐酸:Ca(OH)2+2H+==2H2O+Ca2+ |
| B.硫酸氢钠溶液中逐滴加入氧氧化钡溶液,至溶液恰好呈中性: Ba2++OH-+SO42-+H+==BaSO4↓+H2O |
| C.少量Cl2加入FeBr2溶液中:2Fe2+ +Cl2==2Fe3++2Cl- |
| D.向AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.通入适量Cl2,再加碱调整溶液的pH为4 |
| D.直接加铁粉将Cu2+还原出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )| A.溶液中Pb2+和I-浓度都增大。 | B.溶度积常数Ksp增大 |
| C.沉淀溶解平衡向左移动 | D.浓度商Qc增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Pb2+(aq)+2I-(aq),下列描述正确的是 ( )
Pb2+(aq)+2I-(aq),下列描述正确的是 ( )| A.说明PbI2难电离 | B.说明PbI2难溶解 |
| C.这是电离方程式 | D.这是沉淀溶解平衡表达式 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
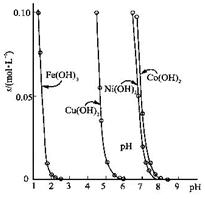
 加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。 | 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤,损耗AgCl少 |
| B.等体积的 pH均等于3的盐酸和AlCl3溶液中,已电离的水分子数前者一定小于后者 |
| C.高效催化剂可使水分解,同时释放能量 |
| D.明矾用于净水和氯气用于自来水的杀菌消毒,两个反应遵循的化学原理不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com