
【题目】已知下列热化学方程式:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1).上述反应中属于放热反应的是________。
(2).H2的燃烧热![]() ________________;C的燃烧热
________________;C的燃烧热![]() ________________。
________________。
(3).燃烧![]() 生成液态水,放出的热量为________。
生成液态水,放出的热量为________。
(4).写出CO燃烧的热化学方程式:________________________________。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1).焓变小于零为放热反应;
(2).根据燃烧热的定义确定燃烧热的数值;
(3).物质的物质的量与焓变成正比,将质量换算成物质的量,进行计算;
(4).根据盖斯定律可知,![]() 可得CO燃烧的热化学方程式;
可得CO燃烧的热化学方程式;
![]() 的反应属于放热反应;
的反应属于放热反应;![]() 的反应属于吸热反应,根据给出的热化学方程式可知:
的反应属于吸热反应,根据给出的热化学方程式可知:![]() 三个反应的
三个反应的![]() 都属于放热反应,
都属于放热反应,
故答案为:![]() ;
;
![]() 根据燃烧热的定义知:
根据燃烧热的定义知:![]() 燃烧时生成液态水更稳定,所以
燃烧时生成液态水更稳定,所以![]()
![]()
![]() 就是氢气的燃烧热化学方程式,其燃烧热
就是氢气的燃烧热化学方程式,其燃烧热![]()
![]() ;碳燃烧时生成
;碳燃烧时生成![]() 更稳定,所以
更稳定,所以![]()
![]() 就是碳的燃烧热化学方程式,其燃烧热
就是碳的燃烧热化学方程式,其燃烧热![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 由热化学方程式
由热化学方程式![]() 可知:
可知:![]()
![]() ,
,![]() 燃烧生成气态水放出的热量为
燃烧生成气态水放出的热量为![]() ,则
,则![]() 燃烧生成气态水放出的热量为
燃烧生成气态水放出的热量为![]() ,
,
故答案为:1429kJ;
![]() 根据盖斯定律可知,
根据盖斯定律可知,![]() 可得
可得![]()
![]()
![]()
![]() ,
,
故答案为:![]()
![]() 。
。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】下列表示戊烷燃烧热的热化学方程式正确的是( )
A. C5H12(l)+8O2(g)![]() 5CO2(g) +6H2O(l) ΔH=-3 540 kJ·mol-1
5CO2(g) +6H2O(l) ΔH=-3 540 kJ·mol-1
B. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1
5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1
C. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1
5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1
D. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-1
5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
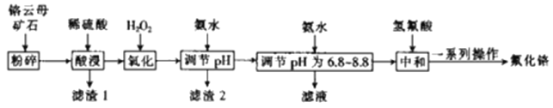
下表列出了相关金属离子生成氢氧化物沉淀的pH:
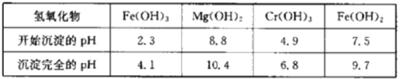
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为___。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为___。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:

①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=___,温度___。
②P点对应的平衡常数为___。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关AgCl沉淀的溶解平衡的说法中正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.100 0 mol·L-1的氢氧化钠溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是 ( )
数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温时,向![]() 溶液中滴加
溶液中滴加![]() 溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示
溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示![]() 无气体溢出
无气体溢出![]() ,以下说法不正确的是
,以下说法不正确的是![]()
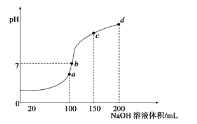
A.a点时水的电离程度最大
B.b点时溶液中的离子浓度关系有![]()
C.c点时溶液中的粒子浓度大小关系为![]()
D.d点时溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.H2(g)+I2(g)![]() 2HI(g)的平衡体系中压缩容器体积后颜色变深
2HI(g)的平衡体系中压缩容器体积后颜色变深
C.Na2CrO4溶液中滴加稀硫酸,溶液颜色变深
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B和Mg在材料科学领域有广泛的应用和发展前景。
回答下列问题:
(1)下列B原子轨道表达式表示的状态中,能量更高的是________![]() 填“A”或“B”
填“A”或“B”![]() 。
。
A. ![]() B.
B. ![]()
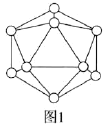
(2)晶体硼中的基本单元如图1所示,其中含有12个B原子。![]() 该单元中含有
该单元中含有![]() 键的数目为________。
键的数目为________。
(3)![]() 是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
是重要的还原剂。其中阴离子的立体构型为________,中心原子的杂化形式为________。
(4)基态Mg原子的核外电子排布式为________;第三周期主族元素中,电负性小于Mg元素的有________![]() 填元素符号,下同
填元素符号,下同![]() ,原子第一电离能小于Mg原子的有________。
,原子第一电离能小于Mg原子的有________。
(5)![]() 和
和![]() 均可作为耐火材料,其原因是________。
均可作为耐火材料,其原因是________。
(6)![]() 常用于光学仪器,其长方体型晶胞结构如图2所示:
常用于光学仪器,其长方体型晶胞结构如图2所示:
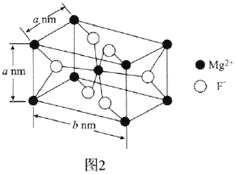
![]() 的配位数为________。
的配位数为________。
![]() 若阿伏加德罗常数的值为
若阿伏加德罗常数的值为![]() ,则
,则![]() 晶体的密度可表示为________
晶体的密度可表示为________![]() 用含a、b、
用含a、b、![]() 的代数式表示
的代数式表示![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com