
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A.0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA
B.1 mol氯气分别与足量铁和铝完全反应时转移的电子数均为3NA
C.28 g乙烯与丙烯混合物中含有C-H键的数目为4NA
D.25℃时1L pH=1的H2SO4溶液中含有H+的数目为0.2NA
【答案】C
【解析】
A. NH4NO3溶液的浓度为0.1mol·L-1,溶液体积不确定,不能计算含有的氮原子数,A错误;
B.氯气分别与足量铁和铝完全反应时,化合价均由0价变-1价,1 mol氯气转移的电子数均为2NA,B错误;
C.如果28g全为乙烯,则含有的C-H键数目 = ![]() ×4×NA = 4NA ;如果28g全为丙烯,则含有的C-H键数目 =
×4×NA = 4NA ;如果28g全为丙烯,则含有的C-H键数目 =![]() ×6×NA = 4NA ,所以无论以何种比例混合,28 g乙烯与丙烯混合物中C-H键数目始终为 4NA ,C正确;
×6×NA = 4NA ,所以无论以何种比例混合,28 g乙烯与丙烯混合物中C-H键数目始终为 4NA ,C正确;
D. pH=1的H2SO4溶液中,H+的浓度为0.1 mol·L-1,故1L溶液中含有H+的数目为0.1NA,D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】最新研究表明,咖啡中含有的咖啡酸是某种抗氧化剂的成分之一,对人体中的氧自由基有清除作用,使人的心脑血管更年轻。咖啡酸的球棍模型如图所示(只含有碳氢氧),下列有关咖啡酸的叙述中不正确的是( )
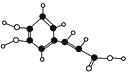
A.咖啡酸的分子式为C9H8O4
B.咖啡酸中含有的官能团只有羧基、羟基
C.咖啡酸可以发生氧化反应、酯化反应、加聚反应
D.![]() 是咖啡酸的一种同分异构体,1 mol该物质与NaOH溶液反应时最多消耗NaOH的物质的量为3 mol
是咖啡酸的一种同分异构体,1 mol该物质与NaOH溶液反应时最多消耗NaOH的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题。
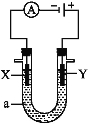
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
(1)电解池中X极上的电极反应式是 ,在X极附近观察到的现象是 。
(2)Y电极上的电极反应式是 ,检验该电极反应产物的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
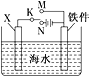
利用如图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为__________,由此可知它______________ (填“含有”或“不含”)非极性键。
(2)长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对HFO的研究引起重视。
①HFO的电子式为_______________________,写出HFO的结构式,并标出HFO中各元素的化合价_________________________。
②次氟酸的名称是否妥当?为什么?___________________________________________。
③次氟酸能与水反应生成两种物质,其中有一种物质常用于雕刻玻璃,试写出次氟酸与水反应的化学方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
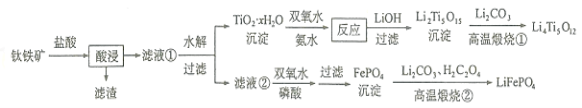
回答下列问题:
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知:当铁的浸出率为70%时,所采用的实验条件为____________________。
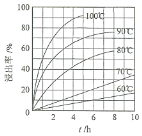
(2) “酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率 | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_____________________。
(4)Li2Ti5O15中Ti的化合价为![]() ,其中过氧键的数目为______________。
,其中过氧键的数目为______________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①![]()
②![]()
③![]()
则下列叙述正确的是
A.由上述热化学方程式可知![]()
B.甲烷的燃烧热为![]()
C.![]()
![]()
D.若甲醇和甲烷的物质的量之比为![]() ,其完全燃烧生成
,其完全燃烧生成![]() 和
和![]() 时放出的热量为
时放出的热量为![]() ,则该混合物中甲醇的物质的量为
,则该混合物中甲醇的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是③O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )

A.反应O3+O===2O2的ΔH=E1-E3B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应D.ΔH=ΔH1+ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com