
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:

已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
(1)写出碳酸锶与盐酸反应的离子方程式_______________。
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜选用的试剂为__________(写一种)。
(3)关于上述流程中各步骤的说法,正确的是_____________。
A.调节pH后加热煮沸的原因是除去H2O2,并避免生成Fe(OH)3胶体
B.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
C.可以通过加快结晶速率的方法来得到较大颗粒的SrCl2·6H2O 晶体
D.步骤⑥干燥SrCl2·6H2O晶体可以采用减压干燥
(4)为了测定所得SrCl2·6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.200mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,当_______________时达到滴定终点,用去NH4SCN溶液20.0mL,则原SrCl2·6H2O晶体的纯度为_________________________。
【答案】SrCO3+2H+=Sr2++H2O+ CO2↑ SrO、SrCO3或Sr(OH)2等 ABD 当最后一滴NH4SCN溶液滴入,锥形瓶内试液变为红色,且半分钟内不变色 95.3%
【解析】
以SrCO3为原料制备六水氯化锶SrCl2·6H2O,由流程可以知道,SrCO3和盐酸发生反应:SrCO3+2HCl=SrCl2+H2O+ CO2↑,反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,加入过氧化氢,将Fe2+氧化为Fe3+,然后加硫酸生成硫酸钡沉淀,同时调节溶液pH,使Fe3+转化氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2·6H2O,以此分析解答。
以SrCO3为原料制备六水氯化锶SrCl2·6H2O,由流程可以知道,SrCO3和盐酸发生反应:SrCO3+2HCl=SrCl2+H2O+ CO2↑,反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,加入过氧化氢,将Fe2+氧化为Fe3+,然后加硫酸生成硫酸钡沉淀,同时调节溶液pH,使Fe3+转化氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2·6H2O。
(1)碳酸锶与盐酸反应生成氯化锶、二氧化碳和水,反应的离子方程式为SrCO3+2H+=Sr2++H2O+ CO2↑,
因此,本题正确答案是:SrCO3+2H+=Sr2++H2O+ CO2↑;
(2)调节溶液的pH目的是使铁离子沉淀,调节溶液的pH的同时不能引入其他杂质,所以选择SrO、SrCO3或Sr(OH)2等;
因此,本题正确答案是:SrO、SrCO3或Sr(OH)2;
(3)A.根据以上分析,调节pH后加热煮沸的原因是除去H2O2,并避免生成Fe(OH)3胶体,故A正确;
B.步骤④包括蒸发浓缩、冷却结晶,为防止温度过高使用SrCl26H2O 晶体失水,因此采用60℃的热水浴加热蒸发到溶液表面出现晶膜,然后冷却结晶,故B正确;
C.结晶速率越慢,得到的晶体颗粒越大,采用降低结晶速率的方法来得到较大颗粒的SrCl26H2O 晶体,故C错误;
D.SrCl2·6H2O晶体在61℃时开始失去结晶水,故工业上采用减压烘干或者用50~60℃的热风吹干SrCl2·6H2O晶体,故D正确。
因此,本题正确答案是:ABD;
(4)滴定完全时,多余的SCN-与Fe3+生成Fe(SCN)3而显红色,所以当最后一滴NH4SCN溶液滴入,锥形瓶内试液变为红色,且半分钟内不变色时达到滴定终点,
根据关系式NH4SCN~AgNO3可知,过量的AgNO3的质量为0.2 mol/L×0.02 L×170g/mol=0.68g,则根据:SrCl2·6H2O~2AgNO3
267 2×170
x (2.38g- 0.68g)
样品中SrCl2·6H2O的质量为:x=![]() ×267=1.335g,
×267=1.335g,
则原SrCl2·6H2O晶体的纯度为:![]() ×100%=95.3%;
×100%=95.3%;
因此,本题正确答案是:当最后一滴NH4SCN溶液滴入,锥形瓶内试液变为红色,且半分钟内不变色;95.3%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol·L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol·L-1的K2Cr2O7,溶液完全反应,则元素Cr在被还原的产物中的化合价是(已知Na2SO3被氧化为Na2SO4)
A.+6B.+3C.+2D.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,下列判断正确的是
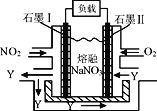
A. 石墨电极Ⅱ为电池负极
B. 电池中NO3-从石墨电极I向石墨电极Ⅱ作定向移动
C. 石墨I电极发生的电极反应为NO2+NO3--e-=N2O5
D. 每消耗1 mol NO2转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(仅含三种元素,摩尔质量为198g·mol-1)具有高效的消毒作用,是一种新型非氮高效消毒剂。为探究化合物A的组成与性质,设计并完成以下实验:取3. 96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL 0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g。将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐。
(1)化合物A所含有的元素:_______________(用元素符号表示)。
(2)化合物A与H2O反应的离子方程式:__________________。
(3)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?________,其理由是___________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浩瀚的海洋是一个巨大的物质宝库,工业上常用浓缩海水提取溴.

下列说法不正确的是( )
A.海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等
B.步骤②中体现了溴易挥发的性质
C.步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42﹣
D.①﹣④目的是为了富集溴元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com