
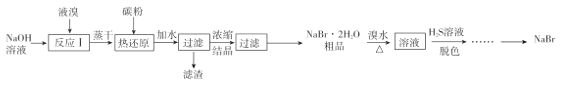
【题目】无水![]() 的制备流程如下:
的制备流程如下:
已知:①![]() ;
;
②![]() 溶于
溶于![]() 溶液生成
溶液生成![]() ,离子方程式可表示为
,离子方程式可表示为![]() 。
。
请回答:
(1) “反应I”所用![]() 溶液最好是饱和溶液,理由是____________
溶液最好是饱和溶液,理由是____________
(2)已知“热还原”反应中,氧化剂和还原剂物质的量之比为![]() ,若该反应中消耗了
,若该反应中消耗了![]() 碳粉,则理论上最终可制得
碳粉,则理论上最终可制得![]() 的质量为_____________(不考虑制备过程中的损失)。
的质量为_____________(不考虑制备过程中的损失)。
(3)“脱色”过程中生成了两种强酸,写出该过程的离子方程式:______________________
(4)用![]() 与
与![]() 溶液反应是制备
溶液反应是制备![]() 的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
【答案】便于后续的蒸干操作 206g ![]() (或
(或![]() )
) ![]()
【解析】
根据已知信息可知,液溴与氢氧化钠溶液反应生成溴化钠与溴酸钠,“热还原”中加入碳粉,将+5价Br还原为-1价Br元素,得到的溴化钠粗品,加入溴水后再加硫化氢进行“脱色”,该过程中,硫化氢将溴水还原为溴离子,据此分析作答。
(1)根据流程可知,便于后续的蒸干操作。
(2)根据氧化剂和还原剂物质的量之比为![]() ,热还原反应为
,热还原反应为![]() ,再结合
,再结合![]() ,可确定
,可确定![]() ,
,![]() 生成
生成![]() 的质量为
的质量为![]()
![]()
![]() =
=![]() ,故答案为:206g;
,故答案为:206g;
(3)“脱色”为![]() 和
和![]() 反应,生成两种强酸为
反应,生成两种强酸为![]() 和
和![]() ,离子方程式为
,离子方程式为![]() ,也可写成
,也可写成![]() ;
;
(4)用![]() 与
与![]() 溶液反应是制备
溶液反应是制备![]() 的另一种方法,反应过程中有气体和沉淀生成,则该气体应为二氧化碳,沉淀为氢氧化铁,其反应的化学方程式为:
的另一种方法,反应过程中有气体和沉淀生成,则该气体应为二氧化碳,沉淀为氢氧化铁,其反应的化学方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】顺铂是一种用于治疗癌症的药物,它的结构如下图所示。关于1 mol顺铂的下列说法中,正确的是( )
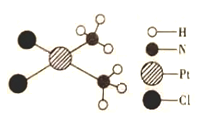
A.含氮元素的质量为14gB.含铂原子的数目约为6.02×1024
C.含氯元素的质量为35.5gD.含氢原子的物质的量6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如右实验:则下列关于原溶液的判断正确的是( )

A.若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Ca2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某1L待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
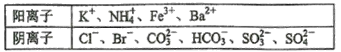
现进行如下实验操作(每次实验所加试剂均过量)
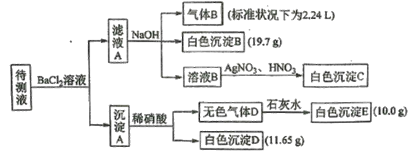
下列说法不正确的是
A.向溶液B中加AgNO3与HNO3的操作是多余的,待测液中一定含有的离子是K+、NH4+、CO32-、HCO3-、且c(K+)≥0.1mol·L-1
B.生成白色沉淀B的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O
C.已知白色沉淀C能溶于浓氨水,离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
D.若无色气体D是混合气体,则沉淀A的成分可能是BaCO3、BaSO3、BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
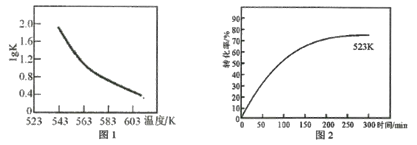
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
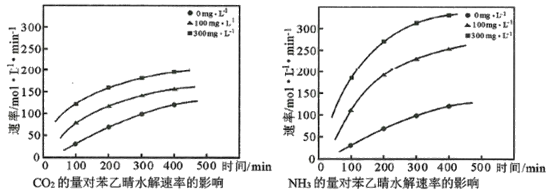
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
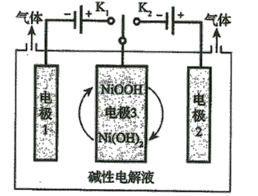
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为1∶2∶1, 则溶液中Al3+和SO42-的离子个数比为__________。
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其总反应的离子方程式为________________。
(4)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为______,反应过程分两步,其中第2步反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
A. 实验室用装置A制取并收集二氧化硫
实验室用装置A制取并收集二氧化硫
B.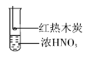 装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
C.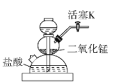 装置C可用于二氧化锰与浓盐酸反应制备氯气
装置C可用于二氧化锰与浓盐酸反应制备氯气
D.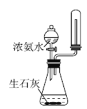 实验室用装置D制取少量氨气
实验室用装置D制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
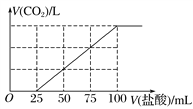
下列判断正确的是( )
A. 通入CO2在标准状况下的体积为448 mL
B. 原NaOH溶液的浓度为0.2 mol·L-1
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是(
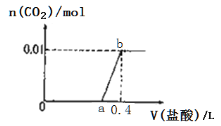
A. 在0~a范围内,只发生中和反应
B. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
C. a = 0.3
D. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com