
| A、M、N、Q三种物质的浓度一定相等 |
| B、M、N全部变成了Q |
| C、反应物和生成物的浓度都保持不变 |
| D、反应已经停止 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
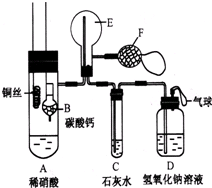 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两个信号,强度之比为1:1 |
| B、三个信号,强度之比为1:1:1 |
| C、两个信号,强度之比为3:1 |
| D、三个信号,强度之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
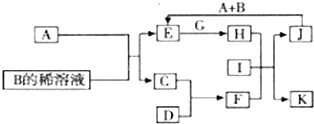 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在所有元素中,氟的电离能最大 |
| B、铝的第一电离能比镁的第一电离能大 |
| C、第3周期所含的元素中钠的第一电离能最小 |
| D、钾的第一电离能比镁的第一电离能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2 |
| B、C2H4 |
| C、C2H6 |
| D、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
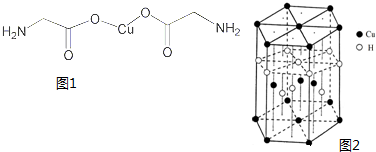 (1)亚铜离子(Cu+)基态时的价电子排布式表示为
(1)亚铜离子(Cu+)基态时的价电子排布式表示为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com