
【题目】下列事实不能用勒夏特列原理解释的是
A. 新制的氯水在光照条件下颜色变浅
B. 打开可乐瓶盖后看到有大量气泡逸出
C. 已知2HI(g)![]() H2(g)+I2(g),对容积可变的密闭容器中已达平衡的HI、I2、H2混合气体进行压缩,混合气体颜色变深
H2(g)+I2(g),对容积可变的密闭容器中已达平衡的HI、I2、H2混合气体进行压缩,混合气体颜色变深
D. 工业上用氮气、氢气合成氨气的过程中,通过加压将氨气液化以增大转化率
【答案】C
【解析】
A、Cl2+H2O![]() HCl+HClO是可逆反应,光照HClO分解降低了HClO浓度,因此平衡正向移动,能用勒夏特列原理解释,选项A不选;B、CO2(g)=CO2(aq),由于打开瓶盖后外部气压比里面气压小,CO2会溢出,减小了CO2(g)浓度,因此平衡逆向移动,能用勒夏特列原理解释,选项B不选;C、2HI(g)
HCl+HClO是可逆反应,光照HClO分解降低了HClO浓度,因此平衡正向移动,能用勒夏特列原理解释,选项A不选;B、CO2(g)=CO2(aq),由于打开瓶盖后外部气压比里面气压小,CO2会溢出,减小了CO2(g)浓度,因此平衡逆向移动,能用勒夏特列原理解释,选项B不选;C、2HI(g)![]() H2(g)+I2(g)可逆反应增大压强平衡不移动,颜色变深其实是因为体积减小I2(g)浓度增大引起的,不能用勒夏特列原理解释,选项C选;D、工业上用氮气、氢气合成氨气的过程中,增大压强平衡N2(g) +3H2(g)
H2(g)+I2(g)可逆反应增大压强平衡不移动,颜色变深其实是因为体积减小I2(g)浓度增大引起的,不能用勒夏特列原理解释,选项C选;D、工业上用氮气、氢气合成氨气的过程中,增大压强平衡N2(g) +3H2(g)![]() 2NH3(g)向体积缩小的正反应方向移动,故通过加压将氨气液化以增大转化率,能用勒夏特列原理解释,选项D不选。答案选C。
2NH3(g)向体积缩小的正反应方向移动,故通过加压将氨气液化以增大转化率,能用勒夏特列原理解释,选项D不选。答案选C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 因为晶体硅有熔点高硬度大的性质,所以被用来做芯片
B. 工业上用焦炭在电炉中还原二氧化硅得到含有少量杂质的硅
C. 合金熔点、硬度都低于成分金属,钢是用量最大用途最广的合金
D. 工业生产玻璃、水泥都需要用到的原材料是石英砂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH![]() ):③>①;水电离出的c(H+):①>②
):③>①;水电离出的c(H+):①>②
B. 将pH值相同②和③溶液加水稀释相同的倍数PH变化大的是③
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH![]() )>c(Cl-)> c(NH3·H2O) >c(OH-)>c(H+)
)>c(Cl-)> c(NH3·H2O) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cl2O常温下为气态,溶于水可得只含单一溶质A的弱酸性溶液,且有漂白性,A溶液在放置过程中其酸性会增强。常温下,Cl2O与NH3反应生成离子化合物B、气体单质C和常见液体D,C为空气中含量最多的物质。请回答下列问题:
(1)B的化学式为_______,气体单质C的结构式为_________。
(2)用化学方程式表示A溶液酸性增强的原因______。
(3)A溶液能使紫色石蕊溶液褪色,体现了A具有____性。
(4)固体B与碱共热能生成一种刺激性气味的气体,该气体是_____(填“离子” 或“共价”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
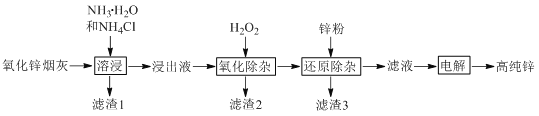
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
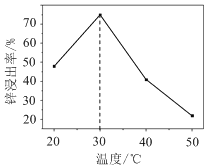
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为________。
(4)“滤渣3”的主要成分为________。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)实验方案中②③④步通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入试剂不合理的顺序是(_____)
A.c b a
B.b c a
C.b a c
D.c a b
(2)如图是中学化学中常用于混合物的分离和提纯的装置,该实验方案中:

(1)在第⑤步操作中要用到的装置是图中的___(填字母),玻璃棒的作用是___;
(2)第⑦步操作的名称是___,所用到的实验装置是上图中的___(填字母),其中用于盛放溶液的仪器名称是___;
(3)检验SO42-是否除尽的操作方法是________;
(4)为提高精盐的产率,第⑤步操作后应对沉淀加以洗涤,请简要描述洗涤的方法是:___;
(5)写出第⑥步可能发生的化学反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
(1)钙原子基态时的电子排布式为___________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是___________。
(2)氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___________位;写出与NO3-互为等电子体的一种非极性分子的化学式___________。
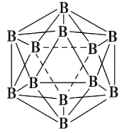
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有___________种不同的结构类型。已知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因____________________________________________。硼酸的结构与石墨相似,层内的分子以氢键相连,含lmol硼酸的晶体中有___________mol氢键。
(4)硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是___________。
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为___________。
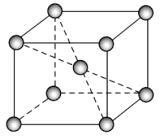
(6)钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为am,密度为ρg/cm3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com