
【题目】甲烷、乙烯和苯三种有机物的共同点是
A. 都由C和H两种元素组成
B. 都能使酸性KMnO4溶液褪色
C. 都能发生加成反应和取代反应
D. 在O2中完全燃烧都生成CO2和H2O
科目:高中化学 来源: 题型:
【题目】(1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________。

(2)部分短周期主族元素的原子半径及主要化合价
元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
原子半径(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
主要化合价 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子结构示意图____________,丙在元素周期表中的位置___________,戊、庚、辛以原子个数比1∶1∶1形成的化合物的结构式______________。
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是___________,辛的单质与己的最高价氧化物的水化物反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱电解质的电离平衡常数 (25℃)。
电解质 | 电离方程式 | 平衡常数K |
CH3COOH | CH3COOH | 1.76 × 10 -5 |
H2CO3 | H2CO3 HCO3— | K1=4.31 × 10 -7 K2=5.61 × 10 -11 |
C6H5OH | C6H5OH | 1.1 × 10 -10 |
H3PO4 | H3PO4 H2PO4— HPO42— | K1=7.52 × 10 -3 K2=6.23× 10 -8 K3=2.20× 10 -13 |
NH3·H2O | NH3·H2O | 1.76× 10 -5 |
回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若 ① CH3COOH ② HCO3— ③ C6H5OH ④ H2PO4— 均可看作酸,则它们酸性由强到弱的顺序为___________(填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:__________________________;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO—)______c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10 mL 0.01 mol/L苯酚溶液中滴加V mL 0.01 mol/L氨水,混合溶液中粒子浓度关系正确的是______;
A.若混合液pH>7,则V≥ 10
B.若混合液pH<7,则c((NH4+) >c (C6H5O—) >c (H+)>c (OH—)
C.V=10时,混合液中水的电离程度小于10 mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O—)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
(1) 与NF3分子互为等电子体的阴离子为________。
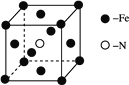
(2) 铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构见图。写出Fe3+的外围电子排布式:_____________,写出该反应的化学方程式:_____________。
(3) 维生素B4结构如图,则1 mol维生素B4分子中含有σ键的数目为________mol。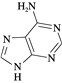
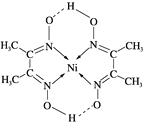
(4) 某配合物的结构如图,其中含有________(填序号);
a. 极性共价键 b. 非极性共价键 c. 配位键 d. 氢键
其中碳原子的杂化方式有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
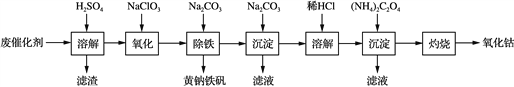
(1) 溶解:溶解后过滤,将滤渣洗涤2~3次,再将洗液与滤液合并的目的是________________________________________________________________________。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是____________________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-===Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3) 除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_____________________________________________________。
(4) 沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是________________________________________________________________________。
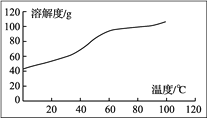
(5) 溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是__________________________________________。
(6) 灼烧:准确称取CoC2O4 1.470 g,在空气中充分灼烧得0.830 g氧化钴,写出氧化钴的化学式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。
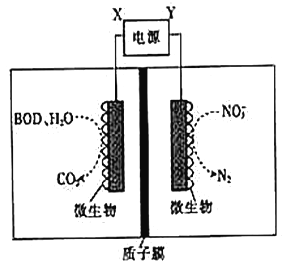
下列说法错误的是
A. X为电源正极
B. 若该装置在高温下进行,则净化效率将降低
C. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极上流出24mole-
D. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A. 该温度高于25℃
B. 由水电离出来的H+的浓度是1.0×10-10mol·L-1
C. NaHSO4晶体的加入抑制了水的电离
D. 该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时在五份蒸馏水中分别加入适量的下列物质,所得实验结果如下表所示:
加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
水的电离程度 | α1 | α2 | α3 | α4 | α5 |
加入物质后水的电离程度由大到小排列顺序正确的是
A.α3>α1>α5>α2>α4 B.α4>α2>α5>α1>α3
C.α4>α2>α5>α3>α1 D.α1>α3>α5>α2>α4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇和乙酸是比较常见的有机物。
(1)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为_______________(不用写反应条件)。
(2)乙醇能够发生氧化反应:乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_______。
(3)下列关于乙醇的说法正确的是______(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.乙醇只能被氧化成乙醛
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
(4)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com