
【题目】探究铝片与Na2CO3溶液的反应:
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 H2和CO2) |
下列说法正确的是( )
A.Na2CO3溶液中存在水解平衡:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑
C.对比Ⅰ、Ⅲ,说明 Na2CO3溶液能破坏铝表面的保护膜
D.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
【答案】C
【解析】
A. Na2CO3是强碱弱酸盐,在溶液中CO32-发生水解反应,CO32-是多元弱酸的酸根离子,其水解反应逐步进行,主要是CO32-+H2O![]() HCO3-+OH-,A错误;
HCO3-+OH-,A错误;
B.碳酸钠水解显碱性,铝表面的氧化铝与碱反应生成偏铝酸根离子,去掉氧化膜后,铝与氢氧根离子、水反应生成氢气,碳酸根离子部分水解生成碳酸氢根离子,碳酸氢根离子与偏铝酸根离子反应生成Al(OH)3沉淀和CO32-,离子方程式:AlO2-+HCO3- +H2O=Al(OH)3↓+CO32-,B错误;
C.依据铝能与热水反应,实验Ⅰ中没有气泡冒出,说明表面有氧化膜,实验Ⅲ有气泡冒出,说明氧化膜被破坏,C正确;
D.盐类水解为吸热过程,加热促进盐类水解;氢气逸出有利于铝与氢氧根离子的反应,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,消耗氢氧根离子,促进碳酸根离子水解,所以加热和H2逸出对CO32-水解平衡移动都起到促进作用,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
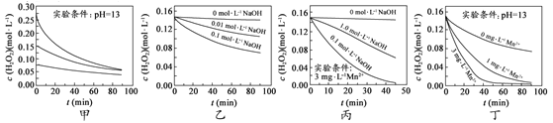
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是重要的化工原料,工业上利用废铁屑(含少量氧化铝、 氧化铁等)生产碱式硫酸铁的工艺流程如下:
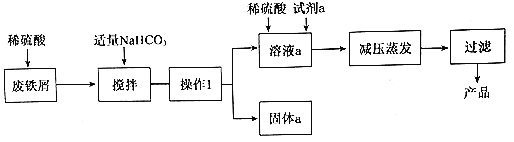
已知:Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17 Ksp[Al(OH)3]=8×10-32(单位略)
(1)工业生产中,常将废铁块处理为废铁屑,其目的是_______;用稀硫酸处理废铁屑的过程中______个氧化还原反应发生。
(2)加入碳酸氢钠后,发生反应的主要离子方程式为_______。
(3)若要使沉淀完全(一般认为离子浓度小于10-5 molL-1即为沉淀完全),溶液的pH为________;此溶液中亚铁离子的物质的量浓度不高于_____molL-1才不会生成沉淀。
(4)从环保、产品纯度角度分析.试剂a最好选择下列物质中的_____(填字母代号)。
A NaClO B KNO3 C H2O2 D KMnO4
(5)若搅拌过程中NaHCO3过量,会产生FeCO3沉淀和大量气泡,若将NaHCO3改为 Na2CO3过量时产生的沉淀为FeCO3和Fe(OH)2的混合物,试解释混合物中有Fe(OH)2的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
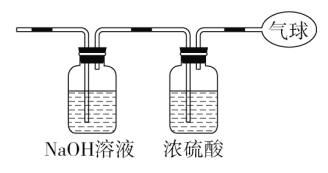
(1)该混合气体的平均摩尔质量:_________________________。
(2)混合气体中碳原子的个数:_________________________
(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:_______________________;
②标况下气球中收集到的气体的体积为___________________;
③气球中收集到的气体的电子总数为_____________________
(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:________。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是__________。
(3)BF3分子中中心原子的杂化轨道类型是____。又知若有d轨道参与杂化,能大大提高中心原子的成键能力,分析BF3、SiF4水解的产物中, 除了相应的酸外,前者生成BF4-而后者生成SiF62-的原因:_______________。
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为_________,其中三种元素的电负性由大到小的顺序是_______________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O710H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是______________(填字母)。

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的_____(填“立方体”“正四面体”或“正八面体”)空隙。建立如图所示坐标系,可得晶胞中A、C处原子的分数坐标,则N处的P原子分数坐标为______。若晶胞中硼原子和磷原子之间的最近核间距为a pm,则晶胞边长为____________cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路:

已知:![]()
![]()
![]() 反应①的化学方程式是______.
反应①的化学方程式是______.
![]() 写出B的结构简式是______.
写出B的结构简式是______.
![]() 反应①~③中属于取代反应的是______
反应①~③中属于取代反应的是______![]() 填序号
填序号![]() .
.
![]() 反应④的化学方程式为是______.
反应④的化学方程式为是______.
![]() 反应⑤的化学方程式是______.
反应⑤的化学方程式是______.
![]() 下列说法正确的是______
下列说法正确的是______![]() 填字母
填字母![]() .
.
a B存在顺反异构
b 1molE与足量的银氨溶液反应能生成2mol![]()
c F能与![]() 反应产生
反应产生![]()
d丁烷、![]() 丙醇和D中沸点最高的为丁烷
丙醇和D中沸点最高的为丁烷
![]() 写出符合下列条件的与
写出符合下列条件的与 互为同分异构体的结构简式______.
互为同分异构体的结构简式______.
![]() 能与浓溴水反应生成白色沉淀
能与浓溴水反应生成白色沉淀![]() 苯环上一氯代物有两种
苯环上一氯代物有两种![]() 能发生消去反应.
能发生消去反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:

(1)A的名称是___________。
(2)填写以下反应的反应类型:①____________;④____________。
(3)物质C中含有的官能团的名称是______________。
(4)反应④的反应试剂及反应条件_______________。
(5)反应②的化学方程式为__________________,反应③的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池DBFC的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2= NaBO2+ 6H2O,有关的说法不正确的是

A. 电极B为正极
B. 放电过程中,Na+从正极区向负极区迁移
C. 电池负极的电极反应为:BH4-+8OH8e=BO2-+6H2O
D. 在电池反应中,每消耗1L6mol/LH2O2溶液,理论上流过电路中的电子为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com