
| A、常温常压下,1 mol甲基(-CH3)所含的电子数为9NA |
| B、9 g重水所含有的电子数为5NA |
| C、标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA |
| D、1molCl2参加反应,转移电子数一定为2NA个 |


科目:高中化学 来源: 题型:
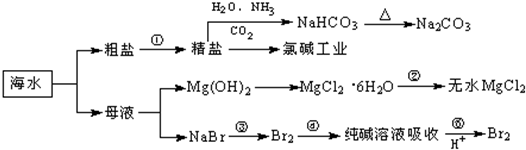
| A、由精盐制备NaHCO3的反应本质上属于复分解反应 |
| B、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C、氯碱工业是通过电解饱和食盐水得到烧碱、氯气和氢气;工业上制取金属镁是通过电解饱和MgCl2溶液 |
| D、在第④步反应中Br2既是氧化剂又是还原剂,在第⑤步反应中Br2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
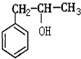 ; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )
; ②CH2=CHCOOCH3;③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH2=CHCOOH( )| A、①③⑤ | B、②④⑤ |
| C、①③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为0.1mol?L-1 |
| B、物质的量浓度为1mol?L-1 |
| C、含氢氧化钠4g |
| D、含氢氧化钠0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1催化剂450℃、1MPa |
| B、450℃、1MPa下,将1mol SO2和0.5molO2置于密闭的容器中充分反应生成SO3(g),放热98.5kJ,其热化学方程式为:2SO2+O2(g)?2 SO3(g)△H=-98.5kJ?mol-1 |
| C、氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓ |
| D、用FeCl3溶液腐蚀铜箔:Cu+2Fe3+═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | F | H | ||||||
| 3 | B | A | C | E | G |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com