
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | F | H | ||||||
| 3 | B | A | C | E | G |
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| B、SO2、SiO2、CO均为酸性氧化物 |
| C、福尔马林、水玻璃、氨水均为混合物 |
| D、烧碱、冰醋酸、四氯化碳均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1 mol甲基(-CH3)所含的电子数为9NA |
| B、9 g重水所含有的电子数为5NA |
| C、标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA |
| D、1molCl2参加反应,转移电子数一定为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
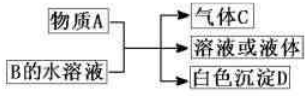
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com