
酸性条件下20mL、0.5mol/L的 KMnO4溶液可将25mL、2mol/L的FeSO4溶液中的 Fe2+氧化为Fe3+,
则KMnO4被还原的产物是( )
A.Mn2O3 B.Mn2+ C.MnO2 D.K2MnO4
科目:高中化学 来源: 题型:
可逆反应A+B(s)⇌C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
|
| A. | A为固体,C为气体,正反应为放热反应 |
|
| B. | A、C均为气体,正反应为吸热反应 |
|
| C. | A为气体,C为固体,正反应为吸热反应 |
|
| D. | A为气体,C为固体,正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I. 取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III. 向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I的说明 ;
② 实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH约为3。由此,乙认为红色不褪去的可能原因是 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i |
| 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质都属于强电解质的是( )
A.KCl、HCl、CO2 B.Ba(OH)2、CH3COOH、NH3·H2O
C.NaHCO3、BaSO4、HNO3 D.H2SO4、Fe(OH)3、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
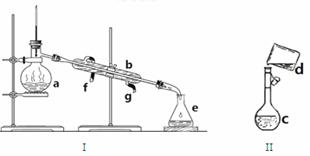
(1)写出下列仪器的名称:a. 、 b. 、 c.
(2)仪器a~e中,使用前必须检查是否漏水的有 (填序号)
(3)若用装置I分离水和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 口通入, 口流出(填f或g)
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是
②除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:
③根据计算得知,所需NaOH的质量为 g
④配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称一定质量的NaOH固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.恢复到室温后将NaOH溶液沿玻璃棒注入500mL的容量瓶中(有少量溶液因操作不慎溅出瓶外)
D.将容量瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,仰视使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
⑤按以上操作步骤配得的NaOH溶液的物质的量浓度 (填“偏大”、“不变”或“偏小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是 ( )
A.由水电离出的c(H+):③<①
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)> c(H+)
> c(Na+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
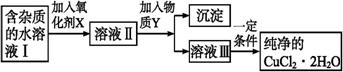
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
请回答下列问题:
(1)加入氧化剂的目的是 。
(2)最适合作氧化剂X的是 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)若不用物质Y而是直接用碱能不能达到目的? (填“能”或“不能”)。若不能,试解释原因 。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是 。(3分)
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中有丰富的食品、矿产、能、药物和水产资,下图为海水利用的部分过程。下列有关说法正确的是( )
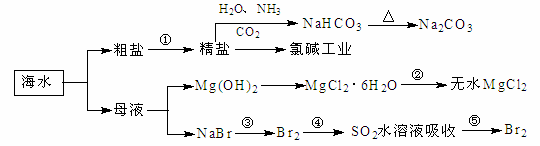
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com