
【题目】现有下列物质:①NaHCO3 ②Na2CO3 ③Al2O3 ④Fe(OH)3 ⑤Al(OH)3 ⑥CO2 ⑦FeCl3 ⑧FeCl2 ⑨MgCl2 ⑩N2 Na2SO4·10 H2O
(1)其中既能跟稀H2SO4反应,又能跟NaOH溶液反应的是 (填序号),
(2)除去固体②中的固体①的方法是 ;
(3)在同温同压下,测得⑩与⑥混合气体对氢气的相对密度为18,⑩的⑥体积之比为 ;
(4)欲配制250 mL0. 1 mol/L的Na2SO4溶液需要称量的质量为 g ;
(5)在①④⑤⑧中可以通过化合反应得到的物质有 (填序号);
(6)要除去⑦溶液中的少量⑧,可行的办法是
A.滴入KSCN溶液 B.加入氯水 C.加入铜粉 D.加入铁粉
【答案】
(1)①③⑤(2)加热(3)1:1
(4)8.1(5)①④⑧(6)B
【解析】
试题分析:(1)在①NaHCO3 ②Na2CO3 ③Al2O3 ④Fe(OH)3 ⑤Al(OH)3 ⑥CO2 ⑦FeCl3 ⑧FeCl2 ⑨MgCl2 ⑩N2 Na2SO4·10 H2O中,既能跟稀H2SO4反应,又能跟NaOH溶液反应的有①③⑤,②④只能与硫酸反应,⑥⑦⑧⑨只能与氢氧化钠反应,⑩与硫酸和氢氧化钠均不反应,故答案为:①③⑤;
(2)碳酸氢钠受热容易分解生成碳酸钠,可以选用加热分解的方法除去碳酸钠固体中的碳酸氢钠,故答案为:加热;
(3)在同温同压下,测得⑩与⑥混合气体对氢气的相对密度为18,则混合气体的平均摩尔质量为18×2g/mol=36g/mol,则根据十字交叉法,![]() ,二氧化碳和但的体积之比等于物质的量之比=
,二氧化碳和但的体积之比等于物质的量之比=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)250 mL0. 1 mol/L的Na2SO4溶液需要Na2SO4·10 H2O的质量=0.25L×0. 1 mol/L×142g/mol=8.05g,需要称量Na2SO4·10 H2O的质量为8.1g,故答案为:8.1g;
(5)在水溶液中碳酸钠与二氧化碳化合生成碳酸氢钠;氢氧化亚铁、氧气和水化合生成氢氧化铁;氧化铝不溶于水,不能化合生成氢氧化铝;氯化铁与氯气化合生成氯化亚铁,故答案为:①④⑧;
(6)要除去氯化铁溶液中的少量氯化亚铁,可以选用氧化剂将其氧化为氯化铁,故选B。


科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂。其一种生产工艺原理如下:
①2NaClO3+SO2+H2SO4==2ClO2+2NaHSO4
②2ClO2+NaCl![]() 2NaClO2+Cl2
2NaClO2+Cl2
回答下列问题:
(1)NaClO2中的Cl 的化合价__________。
(2)将反应①改为离子反应方程式_______________________。
(3)标出反应②的电子转移的方向和数目_________________________。
(4)用于电解的食盐水需先除去其中Ca2+、Mg2+、SO42-等杂质,除杂操作时,依次加入的试剂顺序为NaOH、_________、_________充分反应后,将沉淀一并过滤除去。
(5)电解产生的尾气中有少量ClO2,(二氧化氯具有强氧化性)可以用H2O2碱性溶液吸收除去,该反应中的氧化产物为_________。
(6)KClO2和Cl2均能将电镀废水中CN- 氧化为无毒的物质,自身被还原为Cl-。处理含CN- 相同量电镀废水所需Cl2的物质的量是KClO2__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1____________ΔH2(填“>”“<”或“=”下同)。
(2)相同条件下,2 mol氢原子所具有的能量____________1 mol 氢分子所具有的能量。
(3)已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol可溶正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为_______________
(4)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
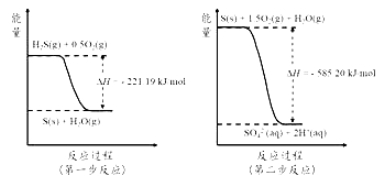
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(5)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
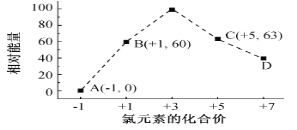
①D是______________________ (填离子符号)。
②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们欲寻找一种新型的半导体材料,可以在元素周期表的( )
A.任意位置寻找
B.稀有气体元素中寻找
C.金属和非金属的分界线处寻找
D.活泼金属和活泼非金属区中寻找
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池获得了广泛的使用,根据电池的电极反应,下列判断正确的是
A. Zn为负极,MnO2为正极。
B. Zn为正极,MnO2为负极。
C. 工作时电子由MnO2经外电路流向Zn极。
D. Zn电极发生还原反应,MnO2电极发生氧化反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关的判断或表示方法正确的是
A.一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1
B.中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验。
C.在测定中和热的实验中,至少需要测定并记录的温度是3次
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)I.甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X(一种钠盐)溶液鉴别它们,已知气体B的密度在同温同压下是氢气密度的22倍。试根据下图中的转化关系回答问题:
(1)下列物质的化学式分别为:甲____________、丙_____________、丁__________;
(2)戊的电子式为________________________;
(3)写出白色沉淀A与乙反应的离子方程式为__________________________。
II.已知:工业制备二甲醚的催化反应室中进行下列反应
CO(g)+2H2(g)![]() CH3OH(g)△H=-90.7kJ/mol①
CH3OH(g)△H=-90.7kJ/mol①
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ/mol③
CO2(g)+H2(g)△H=-41.2kJ/mol③
催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的△H= _____________。
CH3OCH3(g)+CO2(g)的△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中ΔH1小于ΔH2的是
(1)S(s)+O2(g)===SO2(g),ΔH1
S(g)+O2(g)===SO2(g),ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l),ΔH1
CH4(g)+1.5O2(g)===CO(g)+2H2O(g),ΔH2
(3)4Al(s)+3O2(g)===2Al2O3(s),ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s),ΔH2
(4)放热反应CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
CO(g)+2H2(g)![]() CH3OH(l)ΔH2
CH3OH(l)ΔH2
A.只有(2) B.只有(2 ) (4)
C.只有(1) (2 ) (4) D.只有(2 ) (3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是

A.溶液酸性越强,R 的降解速率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com