
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A.当它们的体积和温度、压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:P(H2)>P(N2)>P(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将表面氧化的镁条2.8 g投入100 mL稀硫酸中至不再产生气泡为止,共收集到标准状况气体2.24 L。向所得溶液中滴入4.0 mol﹒L-1的氢氧化钠溶液,开始滴入时无沉淀生成,滴加一定量的氢氧化钠溶液后开始出现白色沉淀,当滴加氢氧化钠溶液体积至100 mL时,恰好使沉淀完全。试求(溶液体积变化忽略不计):
(1)镁条中已被氧化的镁和未被氧化的镁的物质的量之比____________;
(2)最终所得溶液中溶质的物质的量浓度___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢元素与其他元素形成的化合物称为氢化物,下列有关氢化物的叙述不正确的是
A. D2O分子的空间构型为直线形B. NH3的结构式为![]()
C. HCl分子中含有3个孤电子对D. H2S和H2O分子的中心原子都采用sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
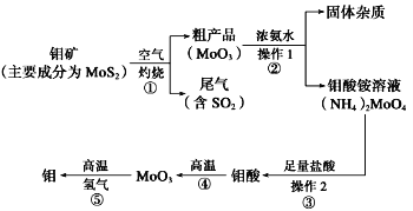
(1)写出在高温下发生反应①的化学方程_____
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:___
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_____
(4)某同学利用如图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:

①步骤⑤的化学反应方程式为___。请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是____。
②在烧瓶A中加入少量硫酸铜的目的是__
③两次使用D装置,其中所盛的药品依次是_____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素,如图是元素周期表短周期的一部分,下列说法中正确的是( )
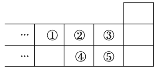
A. 元素①位于第二周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在实验室进行氨气快速制备与性质探究实验的组合装置,部分固定装置未画出。
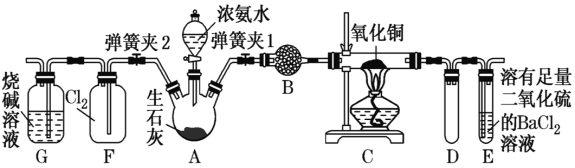
(1)装置B中盛放的试剂是________________。装置D的作用是____________。
(2)点燃C处酒精灯,并闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗活塞,稍等片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生白色沉淀,从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:__________________________。E中发生反应的离子方程式:________。
(3)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16g,反应后固体质量减少2.4g,通过计算确定该固体产物的成分______________________________(用化学式表示)。
(4)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:________________,迅速产生倒吸的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
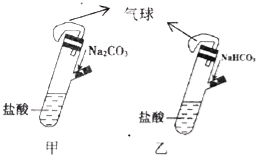
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图:
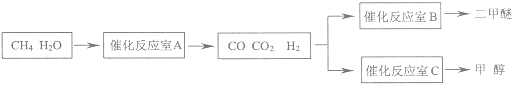
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为___。
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……(Ⅰ)
CO(g)+3H2(g)……(Ⅰ)
CO(g)+H2O(g)![]() CO2(g)+H2(g)……(Ⅱ)
CO2(g)+H2(g)……(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)![]() CH3OH(g)……(Ⅲ)
CH3OH(g)……(Ⅲ)
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率=![]() ×100%。试求反应(Ⅳ)的原子利用率为___。
×100%。试求反应(Ⅳ)的原子利用率为___。
②反应(Ⅳ)的△S___0(填“>”、“=”或“<”)。
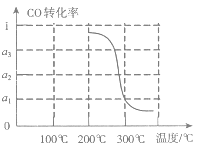
③在压强为5MPa,体积为V L的反应室c中,a mol CO与2a mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如图。则该反应的△H___0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K=___(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。该燃料电池负极的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入 NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下V L的废气,计算消耗二甲醚的质量___。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com