
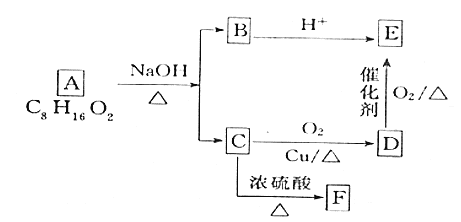
【题目】I.有机物间存在如图转化关系,C在核磁共振氢谱中出现4组峰,其峰面积之比为6:2:1:1。回答下列问题:
(1)C物质的同系物中,有一种物质的浓度为![]() 的溶液,能达到良好的消毒、杀菌作用,该物质的名称是________。
的溶液,能达到良好的消毒、杀菌作用,该物质的名称是________。
(2)D的官能团的名称是________。
(3)六种有机物中能跟![]() 反应的是_______________(填字母)。
反应的是_______________(填字母)。
(4)由A生成B、C的化学反应方程式为____。
(5)已知F能使溴的四氯化碳溶液褪色,G是F同系物中最简单的物质,完成用G和对苯二甲酸为原料经3步反应制备对苯二甲酸乙二醇酯的合成路线(有机物写结构简式,其它试剂任选)_________
Ⅱ.物质J是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分反应条件已略)
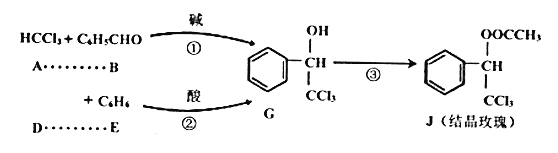
(1)A物质的类别是_______。反应②是加成反应,则D物质的结构简式是_______。
(2)③的反应类型为_______。
(3)G的同分异构体L遇![]() 溶液显紫色,与足量饱和溴水反应未见白色沉淀产生,则L的结构简式为_______。(只写一种)
溶液显紫色,与足量饱和溴水反应未见白色沉淀产生,则L的结构简式为_______。(只写一种)
【答案】乙醇 醛基 C、E ![]() +NaOH
+NaOH![]()
![]() +
+![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH
HOCH2CH2OH ![]()
![]() 卤代烃
卤代烃 ![]() 取代反应或酯化反应
取代反应或酯化反应 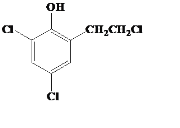 (或
(或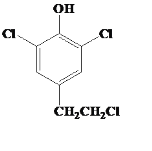 等合理答案)
等合理答案)
【解析】
Ⅰ.有机物A在氢氧化钠水溶液、加热条件下发生水解反应生成B和C,C可以连续两次氧化生成E,B酸化也生成E,故有机物A为酯,C为醇,B为羧酸盐,E为羧酸,D为醛,且B、C、D、E含有相同的碳原子数目4,且C在核磁共振氢谱中出现4组峰,其峰面积之比为6:2:1:1,则C为(CH3)2CHCH2OH,D为(CH3)2CHCHO,E为(CH3)2CHCOOH,B为(CH3)2CHCOONa,故A为(CH3)2CHCOOCH2CH(CH3)2,据此分析。
Ⅱ.根据流程,有机物G可以由两种途径制得,第一种途径为CHCl3与苯甲醛反应生成,第二种途径为有机物D与苯反应生成,有机物G经酯化反应生成有机物J,据此分析。
Ⅰ.(1)根据分析,有机物C属于醇,其同系物中有一种物质的浓度为75 %的溶液,能达到良好的消毒、杀菌作用,该物质的名称是乙醇;
(2)根据分析,有机物D为(CH3)2CHCHO,其结构中含有醛基;
(3)有机物中可以与Na反应的物质为醇和酸,故6种有机物中可以与Na反应的有机物是C和E,故选择CE;
(4)由A反应生成B和C的反应方程式为![]() +NaOH
+NaOH![]()
![]() +
+![]() ;
;
(5)有机物F能使溴的四氯化碳溶液褪色说明有机物F中含有双键,且有机物F为有机物C脱水而来,故有机物F为(CH3)2C=CH2,有机物G是有机物F的最简单同系物,则有机物G为乙烯,利用乙烯和对苯二甲酸制备对苯二甲酸乙二醇酯,可先将乙烯转化为乙二醇,乙二醇与对苯二甲酸发生酯化反应生成目标产物,合成路线为:CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]()
![]() ;
;
Ⅱ.(1)根据有机物A的结构,有机物A属于卤代烃;反应②是加成反应,根据加成反应的定义,则D物质的结构简式是Cl3CCHO;
(2)反应③为醇和酸的反应,生成物J为醇,则反应③的反应类型为酯化反应(或取代反应);
(3) G的同分异构体L遇FeCl3溶液显紫色,说明有机物L中含有酚羟基,与足量饱和溴水反应未见白色沉淀产生说明酚羟基的邻对位上被其他原子或原子团占用,故符合条件的其中一种有机物的结构为 或
或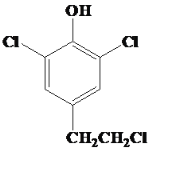 等。
等。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】将V1 mL 1.00mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是

A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.18 g冰水混合物中有NA个原子和10NA个电子
B.常温常压下16 g 氧气和臭氧混合气体含有NA个氧原子
C.标准状况下,33.6 L水含有1.5NA个水分子
D.2.24 L二氧化碳中含有0.3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列方法中可以证明 2HI(g) ![]() H2(g)+I2(g)已达平衡状态的是_________。
H2(g)+I2(g)已达平衡状态的是_________。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H—H 键断裂的同时有一个 H—I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= ![]() v(HI)时;
v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氧化钻![]() 可用于生产合金磁性材料、催化剂等。为充分利用资源,在实验室中探究采用含钴废渣(含
可用于生产合金磁性材料、催化剂等。为充分利用资源,在实验室中探究采用含钴废渣(含![]() 等)来制备复合氧化钴,具体流程如下:
等)来制备复合氧化钴,具体流程如下:

回答下列问题:
(1)![]() 的电子式为_______________________。
的电子式为_______________________。
(2)“碱煮水洗”的目的为______________________________________________。
(3)“酸浸”时,![]() 发生反应的离子方程式为_____________________________________________;滤渣1中主要成分的化学式为_______________________。
发生反应的离子方程式为_____________________________________________;滤渣1中主要成分的化学式为_______________________。
(4)检验“水洗液”中含有![]() 的操作和现象为______________________________________________。上述流程中多次应用过滤操作该操作所用主要玻璃仪器有_____________________。
的操作和现象为______________________________________________。上述流程中多次应用过滤操作该操作所用主要玻璃仪器有_____________________。
(5)下列装置中,适合进行“焙烧”操作的是_____________________(填选项字母)。
A. B.
B. C.
C. D.
D.
(6)称量![]() ,充分“焙烧”后得复合氧化钴
,充分“焙烧”后得复合氧化钴![]() ,则复合氧化钻的化学式为________________;“焙烧”过程中生成的气体能参与大气循环,则该过程_______________(填“有”或“无”)氧气参加反应。
,则复合氧化钻的化学式为________________;“焙烧”过程中生成的气体能参与大气循环,则该过程_______________(填“有”或“无”)氧气参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:
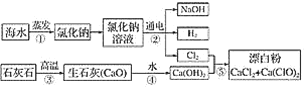
(1)②中的反应物是氯化钠和________,该反应的离子程式为_________。
(2)写出反应④、⑤的化学方程式:_________。
(3)图中反应②③④⑤属于氧化还原反应的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3molH-H键断裂同时生成3molH-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 对于平衡体系:mA(g)+ nB(g)![]() pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com