
【题目】下列说法中正确的是( )
A.22.4L CO2与足量Na2O2反应转移的电子数为NA
B.1mol·L-1的NaOH溶液中含Na+数目为NA
C.78gNa2O2晶体中含有的阴离子数目为2NA
D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag
【答案】D
【解析】
A、缺标准状况,无法计算22.4L CO2的物质的量,无法确定与足量Na2O2反应转移的电子数,故A错误;
B、缺溶液的体积,无法计算1mol·L-1的NaOH溶液中NaOH的物质的量,故B错误;
C、Na2O2晶体是由2个钠离子和1个过氧根离子组成的,78gNa2O2的物质的量为1mol,则1molNa2O2晶体中含有的阴离子数目为NA,故C错误;
D、2CO+O2![]() 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2m(Na2CO3)-2m(Na2O2)=2m(CO),可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2m(Na2CO3)-2m(Na2O2)=2m(CO),可知反应后固体质量增加量为CO的质量;2H2+O2 ![]() 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2m(H2O)-m(O2)=2m(H2),则agCO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag,故D正确;
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2m(H2O)-m(O2)=2m(H2),则agCO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】工业上可用![]() 与
与![]() 合成亚硝酰氯
合成亚硝酰氯![]() ,可以用于有机合成。回答下列问题:
,可以用于有机合成。回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及有关反应的热化学方程式如下:
①![]()
②![]()
③![]()
则![]()
![]() __________(用
__________(用![]() 、
、![]() 表示)。
表示)。
(2)![]() 时,在一密闭容器中发生反应:
时,在一密闭容器中发生反应:![]() ,其正反应速率表达式
,其正反应速率表达式![]() 。测得正反应速率和对应浓度的数据如表:
。测得正反应速率和对应浓度的数据如表:
序号 |
|
|
① |
|
|
② |
|
|
③ |
|
|
则![]() __________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
__________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
(3)![]() 时,向体积为
时,向体积为![]() 且带气压计的恒容密闭容器中通入
且带气压计的恒容密闭容器中通入![]() 和
和![]() 发生反应:
发生反应:
![]() 。已知:反应起始和平衡时温度相同。
。已知:反应起始和平衡时温度相同。

①测得反应过程中压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则
所示,则![]() __________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强
__________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则改变的条件是_________。
所示,则改变的条件是_________。
②图2是两位同学描绘的上述反应平衡常数的对数值![]() 与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);
与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);![]() 的值为______。
的值为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物P可用于治疗各种类型高血压及心绞痛,其合成路线如图所示:
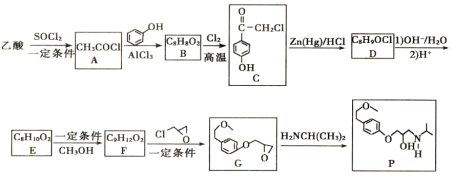
已知:![]()
![]()
(1)P中含氧官能同的名称为______________。
(2)A→B的化学方程式为_______________。
(3)C→D的反应类型为_________________。
(4)F的结构简式为____________,E→F所需的试剂和条件为______________________。
(5)芳香族化合物Q是C的同分异构体,同时满足下列条件的Q有__________种。
①苯环上有三个取代基 ②分子中含有“![]() ”原子团
”原子团
(6)J(![]() )是一种药物中间体,参照上述合成路线和相关信息,设计以苯甲酸、苯酚和
)是一种药物中间体,参照上述合成路线和相关信息,设计以苯甲酸、苯酚和![]() 为原料制备J的合成路线________________(其他无机试剂任选)。
为原料制备J的合成路线________________(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖可发生如下转化:2CH3CH(OH)COOH(乳酸)![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖)![]() 2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,6.0g葡萄糖和乳酸混合物中氧原子数0.2NA
B.1mol葡萄糖中含有6.0NA个羟基
C.1mol乳酸与足量乙醇反应可生成NA个乳酸乙酯分子
D.相同条件下,相同物质的量的乳酸分别与足量的Na和NaHCO3溶液反应,产生气体的分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体氧化物电解池(SOEC)可实现乙烷电化学脱氢制乙烯,原理示意图如图。下列说法错误的是
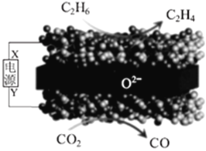
A.X电极的电势高于Y电极
B.该装置在工作过程中,O2-在固体氧化物中由下方向上方迁移
C.该过程总反应的方程式为:C2H6+CO2![]() C2H4+CO+H2O
C2H4+CO+H2O
D.阴极区发生的反应为:CO2+2e-+2H+=CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、C、N、Mg、Al、Si均是重要短周期元素,其化合物在工业中有重要用途。请回答下列问题:
(1)硼氢化合物B2H6的结构如图所示,则B原子的杂化方式为___。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为___中心___(原子)电子键(填阿拉伯数字)。
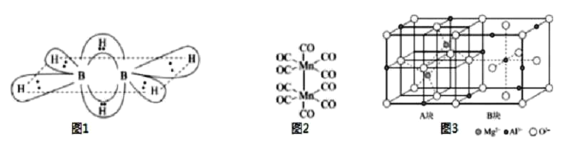
(2)CF4和PF3的沸点比较CF4___PF3(选填“>”或“<”)。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是___。
(3)基态Mn原子核外特征电子排布式为___;已知CO的结构为C![]() O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30、双层n环Si2nOm,当n=10时,m=___。
(5)尖晶石的结构如图3所示,请写出尖晶石的化学式___;A块、B块均为边长为apm的立方体,设阿伏伽德罗常数的值为NA,最近两个Al3+之间的距离为___pm,尖晶石的密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.10molL-1醋酸溶液中滴加0.10molL-1NaOH溶液,滴加过程中测得pH与NaOH溶液体积(V)的关系如图所示。下列说法正确的是( )
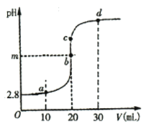
A.m=7
B.由水电离出的c(H+):a>b>c>d
C.由图可知,醋酸Ka的数量级为10-6
D.b与d之间的任意一点c都有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据信息写出下列反应的方程式或填充合适的物质。
⑴氢氧化铟[In(OH)3]广泛应用于电子行业。以氧化铟废渣(主要含In2O3和Fe3O4)为原料制备氢氧化铟的一种工艺流程如下:
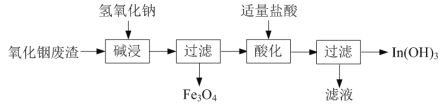
已知:In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在。
①写出“碱浸”时反应的离子方程式:______。
②写出“酸化”时反应的离子方程式:______。
⑵下表所示为部分酸的电离平衡常数:
酸 | H2SO3 | CH3COOH | HCOOH |
电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:______。
⑶下表所示为部分物质的溶度积常数:
难溶物 | Mn(OH)2 | Co(OH)2 | MnCO3 |
溶度积常数 | 2×10-13 | 5.9×10-15 | 2.2×10-11 |
①从NaOH、Co(OH)2中选取合适的物质,填在如下转化关系中:MnCl2→Mn(OH)2。______
②NaNO3、Na2CO3中选择合适的物质,填在如下转化关系中:MnCl2→NaCl。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com