
【题目】依据信息写出下列反应的方程式或填充合适的物质。
⑴氢氧化铟[In(OH)3]广泛应用于电子行业。以氧化铟废渣(主要含In2O3和Fe3O4)为原料制备氢氧化铟的一种工艺流程如下:
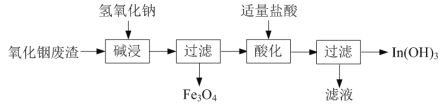
已知:In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在。
①写出“碱浸”时反应的离子方程式:______。
②写出“酸化”时反应的离子方程式:______。
⑵下表所示为部分酸的电离平衡常数:
酸 | H2SO3 | CH3COOH | HCOOH |
电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:______。
⑶下表所示为部分物质的溶度积常数:
难溶物 | Mn(OH)2 | Co(OH)2 | MnCO3 |
溶度积常数 | 2×10-13 | 5.9×10-15 | 2.2×10-11 |
①从NaOH、Co(OH)2中选取合适的物质,填在如下转化关系中:MnCl2→Mn(OH)2。______
②NaNO3、Na2CO3中选择合适的物质,填在如下转化关系中:MnCl2→NaCl。_______
【答案】In2O3+6OH-=2InO33-+3H2O InO33-+6H+===In(OH)3 HCOO-+H2SO3=== HCOOH+HSO3- NaOH Na2CO3
【解析】
(1)氧化铟废渣(主要含In2O3和Fe3O4)碱浸发生In2O3+6OH-=2InO33-+3H2O,过滤除去Fe3O4,滤液中加盐酸酸化,转化成In(OH)3;
(2)根据电离平衡常数判断酸性强弱;
(3)根据溶度积判断。
(1)①In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在,“碱浸”时反应的离子方程式:In2O3+6OH-=2InO33-+3H2O;
②InO33-盐酸化后生成In(OH)3,“酸化”时反应的离子方程式:InO33-+6H+===In(OH)3;
(2)电离平衡常数越大,酸性越大,酸性:H2SO3>HCOOH>CH3COOH>HSO3-,实现HCOONa→HCOOH的转化,只有通入SO2,该反应的离子方程式:HCOO-+H2SO3=== HCOOH+HSO3-;
(3)Mn(OH)2是难溶物质,MnCl2+2NaOH→Mn(OH)2↓+2NaCl,Co(OH)2比Mn(OH)2更难溶,故选NaOH;
MnCO3难溶,MnCl2+Na2CO3=MnCO3↓+2NaCl,Mn(NO3)2易溶,不能用NaNO3,故选Na2CO3。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.22.4L CO2与足量Na2O2反应转移的电子数为NA
B.1mol·L-1的NaOH溶液中含Na+数目为NA
C.78gNa2O2晶体中含有的阴离子数目为2NA
D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用途广泛。某探究小组同学以废铜屑(含杂质铁)为原料,在实验室用如图所示装置制取硫酸铜,再进一步从所得溶液中获得无水硫酸铜。
用途广泛。某探究小组同学以废铜屑(含杂质铁)为原料,在实验室用如图所示装置制取硫酸铜,再进一步从所得溶液中获得无水硫酸铜。

Ⅰ.制备![]() 晶体
晶体
(1)仪器M名称为________。
(2)将反应温度控制在70℃-80℃,可采用的加热方法是________。
(3)从反应后的混合溶液中获得硫酸铜晶体的操作步骤如下:
①向溶液中加入________(填标号)至稀溶液pH约为4,过滤。
a. CuO b. NaOH溶液 c.![]()
②将滤液________、________(填操作名称)过滤、用乙醇洗涤、低温干燥,得![]() 晶体。
晶体。
(4)用乙醇代替蒸馏水洗涤晶体的目的是________,并缩短干燥所需时间。
Ⅱ.制备无水![]()
(5)灼烧法:实验室可在________(填仪器名称)中灼烧![]() ,晶体制备无水
,晶体制备无水![]() 。
。
(6)![]() 法:该方案采用如下图装置,________(填操作名称)A使
法:该方案采用如下图装置,________(填操作名称)A使![]() 气体进入装有
气体进入装有![]() 晶体的硬质玻璃管(已知:
晶体的硬质玻璃管(已知:![]() 的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体)。装置B中
的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体)。装置B中![]() 和
和![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
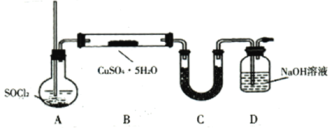
(7)![]() 法:相对灼烧法的优点为________________。(写出一点即可)
法:相对灼烧法的优点为________________。(写出一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四种物质的溶液:①Na2CO3 ②Al2(SO4)3 ③CH3COOH ④NaHCO3。
(1)写出①溶液的电荷守恒:____________。
(2)常温下,0.1 mol·L-1④溶液的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”或“<”),原因是_______(用离子方程式和必要的文字说明)。
(3)常温下0.1 mol/L的③溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)用②和④的溶液可以制作泡沫灭火剂,其原理为:________________(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。
是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。![]() 、
、![]() 、
、![]() 三种元素原子的最外层电子数相同,
三种元素原子的最外层电子数相同,![]() 与
与![]() 能够形成原子之比为
能够形成原子之比为![]() 的化合物
的化合物![]() ,
,![]() 是前四周期基态原子含有未成对电子数目最多的元素,
是前四周期基态原子含有未成对电子数目最多的元素,![]() 与
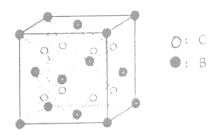
与![]() 形成的晶体
形成的晶体![]() 结构如图所示。试用元素符号回答下列问题:
结构如图所示。试用元素符号回答下列问题:
(1)![]() 、
、![]() 、
、![]() 三种元素的电负性由大到小的顺序为_______。
三种元素的电负性由大到小的顺序为_______。
(2)![]() 与
与![]() 两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
A 都是极性分子 B 都是非极性分子 C 其中一种是极性分子另一种是非极性分子
(3)![]() 元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
(4)![]() 元素的基态原子价层电子排布图为______。
元素的基态原子价层电子排布图为______。
(5)已知![]() 能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与
能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与![]() 互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由
互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由![]() 、
、![]() 、
、![]() 三种元素形成的一种配位离子,试写出该离子的结构式______。
三种元素形成的一种配位离子,试写出该离子的结构式______。
(6)由晶体![]() 的晶胞可知,
的晶胞可知,![]() 离子呈简单立方堆积模型,形成立方体空隙,则
离子呈简单立方堆积模型,形成立方体空隙,则![]() 离子对这些立方体空隙的填充率为_____
离子对这些立方体空隙的填充率为_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素A、B、C、D,它们的核电荷数依次增大。A与C,B与D分别是同主族元素。B、D质子数之和是A、C质子数之和的2倍。这四种元素中A、C、D的单质均可在B的单质中燃烧。
(1)A的元素名称是________,C的元素符号是________。
(2)D元素位于元素周期表的第______周期第______族。
(3)C元素的单质在B的单质中燃烧的产物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
⑴Fe3+可以与SCN-、CN-、有机分子等形成配合物。基态Fe3+的电子排布式为______;与SCN-互为等电子体且为非极性分子的化学式为______。
⑵化合物FeCl3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是______。
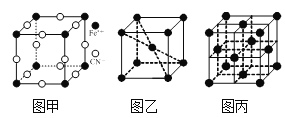
⑶普鲁士蓝俗称铁蓝,结构如图甲所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为______。又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为______。
⑷在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为______,两种晶体中空间利用率较高的是______。(填“图乙”或“图丙”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕。一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO) 等一碳化合物在化工 、医药,能源等方面都有着广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成 1mol HCHO过程中能量变化如图1。

已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ mo1-1,则反应CO2(g)+2H2(g)= HCHO(g) +H2O(g) △H= ___________kJ mo1-1。
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为__________(填化学式)。

(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g)![]() CH3OH(g) △H=akJmo1-1
CH3OH(g) △H=akJmo1-1
①按![]() =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。

②在温度为T1℃,向某恒容密闭容器中充入 H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0 mo1L-1。达到平衡时,CO的转化率为图3中的 M 点对应的转化率,则在该温度下,对应的N 点的平衡常数为__________(保留3 位有效数字)。
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取 H2:CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO浓度(mo1L-1) | H2浓度(mo1L-1) | 逆反应速率(mo1L-1min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上还数据可得该温度下,c2=____________,该反应的逆反应速率常数 k=______L3mo1-3min-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com