
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。
是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。![]() 、
、![]() 、
、![]() 三种元素原子的最外层电子数相同,
三种元素原子的最外层电子数相同,![]() 与
与![]() 能够形成原子之比为
能够形成原子之比为![]() 的化合物
的化合物![]() ,
,![]() 是前四周期基态原子含有未成对电子数目最多的元素,
是前四周期基态原子含有未成对电子数目最多的元素,![]() 与
与![]() 形成的晶体
形成的晶体![]() 结构如图所示。试用元素符号回答下列问题:
结构如图所示。试用元素符号回答下列问题:
(1)![]() 、
、![]() 、
、![]() 三种元素的电负性由大到小的顺序为_______。
三种元素的电负性由大到小的顺序为_______。
(2)![]() 与
与![]() 两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
A 都是极性分子 B 都是非极性分子 C 其中一种是极性分子另一种是非极性分子
(3)![]() 元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
(4)![]() 元素的基态原子价层电子排布图为______。
元素的基态原子价层电子排布图为______。
(5)已知![]() 能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与
能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与![]() 互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由
互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由![]() 、
、![]() 、
、![]() 三种元素形成的一种配位离子,试写出该离子的结构式______。
三种元素形成的一种配位离子,试写出该离子的结构式______。
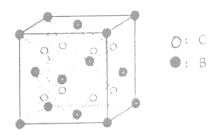
(6)由晶体![]() 的晶胞可知,
的晶胞可知,![]() 离子呈简单立方堆积模型,形成立方体空隙,则
离子呈简单立方堆积模型,形成立方体空隙,则![]() 离子对这些立方体空隙的填充率为_____
离子对这些立方体空隙的填充率为_____![]() 。
。
【答案】![]()
![]()
![]()
![]()
![]() 面心立方最密堆积
面心立方最密堆积 
![]()
 50
50
【解析】
![]() 是前四周期基态原子含有未成对电子数目最多的元素,则D为Cr元素;
是前四周期基态原子含有未成对电子数目最多的元素,则D为Cr元素;![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大,Cr是第四周期,所以E也是第四周期,那么A、B、C为前三周期,则A为H元素;
是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大,Cr是第四周期,所以E也是第四周期,那么A、B、C为前三周期,则A为H元素;![]() 、
、![]() 、
、![]() 三种元素原子的最外层电子数相同,则C为Na元素,E为Cu元素;由图可知晶体
三种元素原子的最外层电子数相同,则C为Na元素,E为Cu元素;由图可知晶体![]() 每个晶胞中含有B个数为
每个晶胞中含有B个数为![]() ,C的个数为8,且B在第二周期,故B为O元素;综上所述,A、B、C、D、E分别为H、O、Na、Cr、Cu。
,C的个数为8,且B在第二周期,故B为O元素;综上所述,A、B、C、D、E分别为H、O、Na、Cr、Cu。
(1)根据分析,A、B、C分别为H、O、Na,H和O为非金属,电负性大于金属Na,且O的电负性大于H的电负性,故有电负性![]() ;
;
(2)H和O组成的化合物有H2O和H2O2,两种物质中O元素形成的都是单键,故都是sp3杂化;H2O分子空间构型为V型,正负电荷中心不重合,是极性分子,H2O2空间构型为折线形( ),正负电荷中心不重合,也是极性分子,故选A;
),正负电荷中心不重合,也是极性分子,故选A;
(3)Cu元素处于周期表的ds区,Cu晶体的晶胞中,每一个面心和八个顶点上都有一个Cu原子,是典型的面心立方最密堆积;
(4)Cr是第24号元素,核外电子排布式属于洪特规则的特例,为[Ar]3d54s1,它的基态原子价层电子排布图为 ;
;
(5)根据分析,X为CuH。CuH与硝酸发生氧化还原反应,硝酸被还原后生成的气体为氮的氧化物,该气体与![]() 互为等电子体,故该气体为N2O,CuH与硝酸反应的化学方程式为:
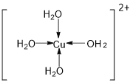
互为等电子体,故该气体为N2O,CuH与硝酸反应的化学方程式为:![]() ;H、O、Cu形成配合物,Cu2+提供空轨道,由H、O 形成的H2O提供孤对电子,形成四水合铜离子为蓝色,该离子的结构式为
;H、O、Cu形成配合物,Cu2+提供空轨道,由H、O 形成的H2O提供孤对电子,形成四水合铜离子为蓝色,该离子的结构式为 ;
;
(6)Na+呈简单立方堆积模型,形成立方体空隙有8个,O2-占有4个,所以O2-对这些立方体空隙的填充率为50%;


科目:高中化学 来源: 题型:
【题目】利用固体氧化物电解池(SOEC)可实现乙烷电化学脱氢制乙烯,原理示意图如图。下列说法错误的是
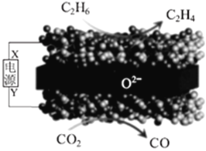
A.X电极的电势高于Y电极
B.该装置在工作过程中,O2-在固体氧化物中由下方向上方迁移
C.该过程总反应的方程式为:C2H6+CO2![]() C2H4+CO+H2O
C2H4+CO+H2O
D.阴极区发生的反应为:CO2+2e-+2H+=CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH–;△H>0,下列叙述正确的是
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )

A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据信息写出下列反应的方程式或填充合适的物质。
⑴氢氧化铟[In(OH)3]广泛应用于电子行业。以氧化铟废渣(主要含In2O3和Fe3O4)为原料制备氢氧化铟的一种工艺流程如下:
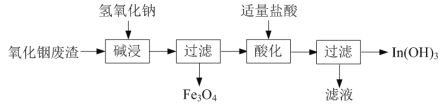
已知:In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在。
①写出“碱浸”时反应的离子方程式:______。
②写出“酸化”时反应的离子方程式:______。
⑵下表所示为部分酸的电离平衡常数:
酸 | H2SO3 | CH3COOH | HCOOH |
电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:______。
⑶下表所示为部分物质的溶度积常数:
难溶物 | Mn(OH)2 | Co(OH)2 | MnCO3 |
溶度积常数 | 2×10-13 | 5.9×10-15 | 2.2×10-11 |
①从NaOH、Co(OH)2中选取合适的物质,填在如下转化关系中:MnCl2→Mn(OH)2。______
②NaNO3、Na2CO3中选择合适的物质,填在如下转化关系中:MnCl2→NaCl。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是某甲醇燃料电池的工作示意图。下列说法正确的是

A.电极b为电池的负极
B.电池工作时将电能转化为化学能
C.放电时a极处所发生的电极反应为:CH3OH-6e-+H2O=CO2↑+6H+
D.放电时溶液中H+向a极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备二甲醚的主要原理如下。下列有关说法正确的是
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.7 kJ·mol-1
CH3OH(g) ΔH1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
A.将1mol CO(g)和2 mol H2(g)充分反应,反应会放出90.7 kJ能量
B.反应①的ΔS>0
C.反应③使用催化剂,ΔH3减少
D.反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质的组成、结构有利于更好的理解物质的性质。

⑴图3是As4S4分子的结构,该分子中含非极性共价键的数目是_____;基态As原子的外围电子排布式是______。
⑵图1是某种晶体的晶胞,该晶体的化学式是______。
⑶图1对应物质与图3对应物质熔点较高的是______,原因是______。
⑷NaCl的熔点为801.3℃,MgO的熔点高达2800℃。MgO熔点高的原因是______。
⑸图3所示是硼酸晶体的层状结构,层内H3BO3分子通过氢键相连。H3BO3分子B原子的轨道杂化方式是______,1 mol H3BO3晶体中含有的氢键数目是_____。
⑹金刚石、晶体硅、金刚砂(SiC)的晶体类型相同,它们的熔点由高到低的顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如图所示装置制备无水FeCl3。

①下列操作步骤的正确顺序为________(填字母)。
a 体系冷却后,停止通入Cl2
b 通入干燥的Cl2赶尽装置中的空气
c 在铁屑下方加热至反应完成
d 用干燥的H2赶尽Cl2
e 检验装置的气密性
②氯化钙的作用是________________________________。把氯化钙换成________(填药品名称)可以改进装置的不足.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com