
【题目】下列电子排布式或轨道表示式正确的是( )
①C原子的轨道表示式:![]()
②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式:![]()
④Br原子的外层电子排布式:3d104s24p5
⑤B原子的轨道表示式:![]()
A.① ② ③B.② ③ ④C.① ② ④ ⑤D.只有③
【答案】D
【解析】
①C是6号元素,原子核外电子排布式是1s22s22p2,其原子的轨道表示式:![]() ,①错误;
,①错误;
②Cr是24号元素,由于原子核外电子处于半充满、全充满或全空时是稳定状态,所以其原子的电子排布式:1s22s22p63s23p63d54s1,②错误;
③O是8号元素,原子核外电子排布式是1s22s22p4,故原子的轨道表示式:![]() ,③正确;
,③正确;
④Br是第VIIA元素,在发生反应时只有最外层电子发生变化,原子的外层电子排布式: 4s24p5,④错误;
⑤B是5号元素,同一轨道上最多可容纳2个自旋方向相反的电子,这样能量最低,原子稳定,故B原子的轨道表示式![]() ,⑤错误;
,⑤错误;
综上所述可知,说法正确的只有③,故合理选项是D。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
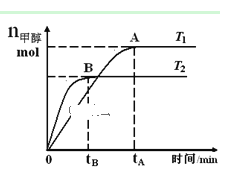
A.平衡常数K =![]()
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是

A.H+由阳极区向阴极区迁移
B.阳极电极反应:2HCl + 2e- == Cl2 + 2H+
C.阴极电极反应:Fe3+ + e- == Fe2+
D.阴极区发生的反应有:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,![]() 某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为
某无色可燃性气体在足量氧气中完全燃烧。将产物通入足量澄清石灰水中,得到白色沉淀的质量为![]() ;若用足量碱石灰吸收燃烧产物,则碱石灰增重
;若用足量碱石灰吸收燃烧产物,则碱石灰增重![]() 。
。
(1)计算燃烧产物中水的质量_____________。
(2)若原气体是单一气体,通过计算推断它的分子式___________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式________________(只要求写出一组)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图1为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔的石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。
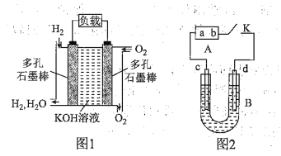
回答下列问题:
![]() 图1中通过负载的电子流动方向为________
图1中通过负载的电子流动方向为________![]() 填“向左”或“向右”
填“向左”或“向右”![]() 。
。
![]() 写出氢氧燃料电池工作时的电极反应式:正极:________,负极:________。
写出氢氧燃料电池工作时的电极反应式:正极:________,负极:________。
以该燃料电池为电源进行实验,如图2所示,B为电解槽,c、d为铁电极,B中装有一定浓度的NaOH溶液,闭合K,c电极周围逐渐析出白色沉淀。
![]() 极是电池的________
极是电池的________![]() 填“正极”或“负极”
填“正极”或“负极”![]() ,c电极的电极反应式为________。
,c电极的电极反应式为________。
![]() 若c、d为石墨电极,B中装有
若c、d为石墨电极,B中装有![]() 和
和![]() 的混合溶液,其中
的混合溶液,其中![]() 的物质的量浓度为
的物质的量浓度为![]() ,
,![]() 的物质的量浓度为
的物质的量浓度为![]() 。闭合K,c电极收集到标准状况下
。闭合K,c电极收集到标准状况下![]() 的一种气体甲。在收集气体甲的过程中电解明显分为两个阶段,请写出相应的电解总化学方程式:第一阶段:________ ;第二阶段:________;d电板理论上收集到的气体体积是________
的一种气体甲。在收集气体甲的过程中电解明显分为两个阶段,请写出相应的电解总化学方程式:第一阶段:________ ;第二阶段:________;d电板理论上收集到的气体体积是________![]() 标准状况下
标准状况下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为__________________;
(2)等浓度的NaHCO3 、Na2CO3混合溶液中的物料守恒表达式为___________________;
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为____________________;
(4) Fe2(SO4)3溶液显酸性,用离子方程式表示其原因____________________;
(5) NaHCO3溶液中粒子浓度由大到小的顺序是______________________________。
(6)常温下,NaHSO3溶液中粒子浓度由大到小的顺序是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)开始进行时,c(NH3)=0.04mol/L,经5min后,c(NH3)=0.03mol/L,则v(H2O)为( )
A.0.003mol/(Lmin)B.0.002mol/(Lmin)
C.0.0045mol/(Lmin)D.0.003mol/(Ls)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com