
����Ŀ���������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ������������ش��������⣺
��1����ҵ�Ͽ���KClO3��Na2SO3��H2SO4�������Ƶ�ClO2���÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ________��
��2������ͼװ�ÿ��Բⶨ�������ClO2�ĺ�����
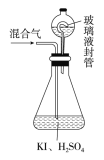
��.����ƿ�м��������ĵ⻯�أ���50mLˮ�ܽ���ټ���3mLϡ���
��.�ڲ���Һ��װ���м���ˮ��ʹҺ��û������Һ��ܵĹܿڣ�
��.��һ�����Ļ������ͨ����ƿ�����գ�
��.������Һ��װ���е�ˮ������ƿ�У�
��.��0.1000mol��L��1��������Ʊ���Һ�ζ���ƿ�е���Һ��I2��2S2O32-=2I����S4O62-����ָʾ����ʾ�յ�ʱ����ȥ20.00mL�����������Һ���ڴ˹����У�
����ƿ��ClO2��⻯�ط�Ӧ�����ӷ���ʽΪ__________����Ӧ��ClO2Ϊ_______����������ԭ����
������Һ��װ�õ�������__________��
�ۢ��м����ָʾ��ͨ��Ϊ________���ζ����յ��������___________��
����û������ClO2������Ϊ________g��
��3����ClO2������������ˮ�Ậ��һ�������������Ρ���Ҫ��ȥ������������Σ��������������˵���________�����ţ���
a����b�⻯��c����d��������
���𰸡�2��1 2ClO2��10I����8H��=5I2��4H2O��2Cl�� ���� ���ղ���Ķ����������壨�������ݳ��� ������Һ ��Һ����ɫ��Ϊ��ɫ���Ұ��������Һ��ɫ���ٸı� 0.02700 d
��������
(1)KClO3��Cl���ϼ۽��ͱ�ΪClO2������1����̬��Na2SO3���ϼ����߱�ΪSO42������2����̬�����ݵ�ʧ�����غ�ó��𰸣�
(2)����ƿ��ClO2��⻯�ط�Ӧ���ɵ��ʵ�������ӣ���������������������ݳ����ۢ��и���I2��2S2O32=2I����S4O62���ó�����ָʾ����������ClO2��5S2O32��ϵʽ���õ�n(ClO2)��m(ClO2)��
(3)a.������c.��������ܻ�ԭ�������Σ�b.KI���л�ԭ�ԣ����������ﲻ��������ˮʹ�ã�d.�����������������ӽ����������ԭΪ�����ӣ�����������Ϊ�����ӣ���������ˮ�����ɽ���ɾ�������ˮ����������ˡ�
(1)��ҵ�Ͽ���KClO3��Na2SO3��H2SO4�������Ƶ�ClO2��KClO3��Cl���ϼ۽��ͱ�ΪClO2����������������1�ۣ�Na2SO3���ϼ����߱�ΪSO42������ԭ��������2�ۣ����ݵ�ʧ�����غ㣬�÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ2:1��
(2)����ƿ��ClO2��⻯�ط�Ӧ���ɵ��ʵ�������ӣ������ӷ���ʽΪ2ClO2��10I����8H��=5I2��4H2O��2Cl����ClO2���ϼ۽��ͣ���˷�Ӧ��ClO2Ϊ��������
��ClO2����������ݳ�����˲���Һ��װ�õ����������ղ���Ķ����������壨�������ݳ�����
�ۢ��и���I2��2S2O32=2I����S4O62����˼����ָʾ��ͨ��Ϊ������Һ���ζ����յ����������Һ����ɫ��Ϊ��ɫ���Ұ��������Һ��ɫ���ٸı䣻�ʴ�Ϊ��������Һ����Һ����ɫ��Ϊ��ɫ���Ұ��������Һ��ɫ���ٸı䣻
������ClO2��5S2O32��ϵʽ���õ�n(ClO2)=![]() n(S2O32)=
n(S2O32)=![]() ��0.1000molL1��0.02L=4��104mol��m(ClO2)=nM=4��104mol��67.5gmol1=0.027g��
��0.1000molL1��0.02L=4��104mol��m(ClO2)=nM=4��104mol��67.5gmol1=0.027g��
(3)a.������c.��������ܻ�ԭ�������Σ���ac���������⣻b.KI���л�ԭ�ԣ����������ﲻ��������ˮʹ�ã���c���������⣻d.�����������������ӽ����������ԭΪ�����ӣ�����������Ϊ�����ӣ���������ˮ�����ɽ���ɾ�������ˮ����������ˣ�d�������⡣��ѡd��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ҷ���![]() �������ɢ���������ڳ������ǰ�ij������������ͼ���Ծ��� ������ζ���л���A Ϊԭ����ȡ���Ҷ����Ĺ��̣����ֲ�������ȥ������ C ��̼����Ԫ�ص�������Ϊ 6��1����ͬϵ����������ʣ�E ���ܷ���������Ӧ��
�������ɢ���������ڳ������ǰ�ij������������ͼ���Ծ��� ������ζ���л���A Ϊԭ����ȡ���Ҷ����Ĺ��̣����ֲ�������ȥ������ C ��̼����Ԫ�ص�������Ϊ 6��1����ͬϵ����������ʣ�E ���ܷ���������Ӧ��
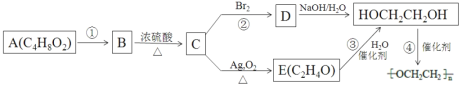
��1��E ���ʵ�������_____��
��2��D �ļ���ʽ��_____��
��3����Ӧ�ܵĻ�ѧ����ʽ��_____��
��4������˵����ȷ����_____��
a��A �����Ի���������¶����Է�Ӧ�õ�B����Ӧ���е� Br2 ��������ˮ����� CCl4 ��Һ
b����ҵ�ϻ��C �ĵ���Ҫ�����Ǵ��ѻ�
c�������ñ���̼������Һ��ȥ B �л��е�����A
d����Ӧ�ٵķ�Ӧ����Ϊˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�л������ȷ����Ϊ (����)

A.2-�һ�-3,3-��������B.3,3-����-4-�һ�����
C.3,3,4-��������D.3,4,4-��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��G��Ԫ�����ڱ���ԭ�������������������Ԫ�ء�XԪ����Ԫ�����ڱ��к˵������С��Ԫ�ء�Y��һ�ֺ��س����ڿ��ţ���һ��ͬ��������Ϊ��Ȼ����Ӳ�����ʡ�ZX3��������ˮ�ʼ��ԡ�W����Χ�����Ų���3s1��G2+���ӵ�M��d���ֻ��5�����ӡ���ش��������⣺
��1��W��Ԫ�����ڱ��е�λ���� ��W��Z�γɵĻ�����ˮ��Һ�ʼ��ԣ������ӷ���ʽ��ʾ��ԭ�� ��
��2��Zԭ�ӵĵ�һ�����ܱ���ԭ�ӵ� ��������������С������G�Ļ�̬ԭ�ӵ����Ų�ʽ��
��3��X��Y���γɶ��ֻ��������һ�ֻ�����ķ���ʽ��X6Y6��������ֻ���������÷��ӵĽṹ��ʽ�� ���û�������Y���ӻ���������� ��
��4��G������������Ӧˮ����ļ��Σ������������£������ڲⶨ��Һ��Fe2+�ĺ������÷�Ӧ�����ӷ���ʽ��
��5������YX4��ԭZOx����������Ⱦ����֪��
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) ��H=" -" 574 kJ��mol-1
YX4(g)+4ZO(g)=2Z2(g)ʮYO2(g) +2X2O(g) ��H =" -1160" kJ��mol-1
��д����YX4��ԭZO2��Z2���Ȼ�ѧ����ʽ___ _��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Co��Ni��������,�ڵ��ӹ�ҵ�Լ�����������Ӧ��ʮ�ֹ㷺.���Ժ��ܡ��������ķ���(����Ҫ�ɷ�ΪCoO��Co2O3��Ni����������Al2O3)��ȡ�ܡ����Ĺ�������:
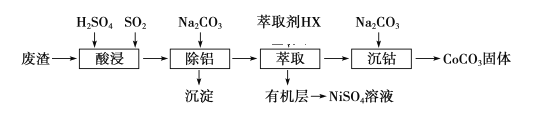
(1)���ʱSO2��������___________________________________��
(2)����ʱ����̼���Ʋ������������ӷ�Ӧ_________________________________��
(3)��CoCO3Ϊԭ�ϲ�����ˮ�ȷ��ͳ���ˮ�ȷ������Ƶ�H2O2�ֽ�ĸ�Ч����CoxNi(����x)Fe2O4(����Co��Ni��Ϊ��2��).��ͼ�������ֲ�ͬ�����Ƶõ�CoxNi(����x)Fe2O4 ��10��ʱ���ֽ�6����H2O2 ��Һ����Գ�ʼ������x �仯����.
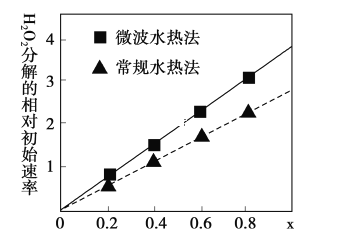
��H2O2 �ĵ���ʽ_________________________________��
����ͼ����Ϣ��֪:_________________________________����ȡ�Ĵ������Ը��ߡ�
��Co2�� ��Ni2�� ���������д�Ч�����õ���_________________________________��
(4)��֪����CoCO3ʱ,�¶Ȳ�ͬ,���ﲻͬ.��400��������CoCO3,�õ����������������2.41g,CO2�����Ϊ0.672L(�����),���ʱ���ù���������Ļ�ѧʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������У�����ԭ�Ӳ�����ͬ��Ԫ��ԭ�ӵ���(����)
A.3p�ܼ���һ���չ���Ļ�̬ԭ�Ӻͺ�����ӵ��Ų�ʽΪ1s22s22p63s23p2��ԭ��
B.2p�ܼ��չ��������һ��δ�ɶԵ��ӵĻ�̬ԭ�Ӻ�ԭ�ӵ����������Ų�ʽΪ2s22p5��ԭ��
C.M��ȫ������N��Ϊ4s2��ԭ�Ӻͺ�������Ų�ʽΪ1s22s22p63s23p64s2��ԭ��
D.�����������Ǻ����������1/5��ԭ�Ӻ����������Ų�ʽΪ4s24p5��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����еķ�Ӧ������ͬһ��Ӧ���͵���
A. �������ˮ���Ʊ������ɱ�ϩ��ˮ��Ӧ�Ʊ���
B. �ɼױ������ƶ������ױ����ɼױ������Ʊ�����
C. ���ȴ���������ȥ�ƻ���ϩ���ɱ�ϩ������![]() �������
�������
D. ��������Ҵ��������������ɱ���������ˮ���Ʊ�������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ŷӹ��������о��ɹ������ȶ���ǿ�������״������DZ����ҩ����ϳ�·�����£�
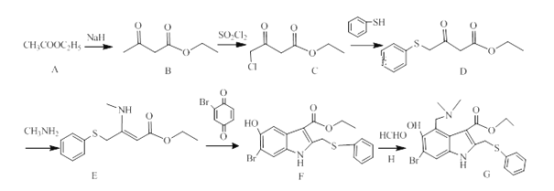
��1��C�ĺ������������ƣ�_______ ��G�ķ���ʽ��_____________ ��
��2��A��B��B��C�ķ�Ӧ���ͷֱ�Ϊ��_____________ ��_____________ ��������A����B����һ�ֲ���ò���ṹ��ʽΪ��_____________ ��
��3��D����E�ķ�Ӧ����ʽ��______________ ��
��4��H�Ľṹ��ʽΪ��_____________ ��
��5��д��B��ͬ���칹���о����������������Ľṹ��ʽ��_____��
����̼�����Ʒ�Ӧ����ʹ����ʯ��ˮ����ǵ����� ����Ԫ��״�ṹ
��6����������ϳ�·�ߣ���д�����Ҵ���![]() Ϊ����ԭ�ϣ��ϳ�
Ϊ����ԭ�ϣ��ϳ�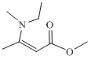 ��·�ߣ�������4������____________��
��·�ߣ�������4������____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com