
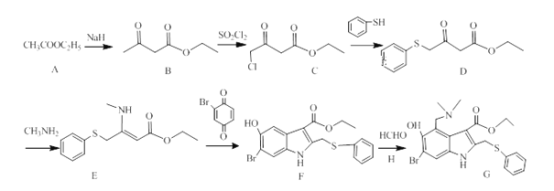
【题目】李兰娟团队公布最新研究成果,阿比朵尔是抗击新型冠状病毒的潜在用药。其合成路线如下:
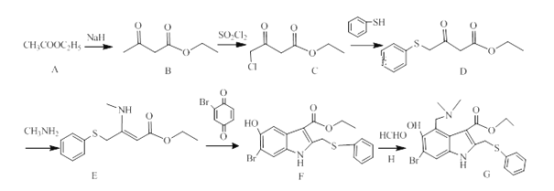
(1)C的含氧官能团名称:_______ 。G的分子式:_____________ 。
(2)A→B和B→C的反应类型分别为:_____________ ,_____________ 。两分子A生成B和另一种产物,该产物结构简式为:_____________ 。
(3)D生成E的反应方程式:______________ 。
(4)H的结构简式为:_____________ 。
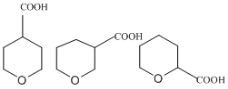
(5)写出B的同分异构体中具有满足下列条件的结构简式:_____。
①与碳酸氢钠反应产生使澄清石灰水变浑浊的气体 ②六元环状结构
(6)结合上述合成路线,请写出由乙醇和![]() 为基本原料,合成
为基本原料,合成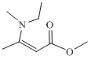 的路线(不超过4步)。____________。
的路线(不超过4步)。____________。
【答案】羰基、酯基 C21H23O3N2SBr 取代反应 取代反应 CH3CH2OH  NH(CH3)2 或
NH(CH3)2 或![]()

【解析】
CH3COOC2H5在NaH作用下生成B![]() ,B与SO2Cl2发生取代反应生成C
,B与SO2Cl2发生取代反应生成C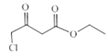 ,C与
,C与![]() 发生取代反应生成D
发生取代反应生成D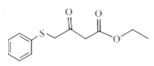 ,D与氨基甲烷反应生成E
,D与氨基甲烷反应生成E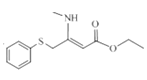 ,E与
,E与![]() 生成F
生成F ,F与HCHO和二甲基氨生成产品G
,F与HCHO和二甲基氨生成产品G 。
。
(1)C 的含氧官能团名称: 羰基、酯基 。由G的结构简式,G的分子式:C21H23O3N2SBr。
的含氧官能团名称: 羰基、酯基 。由G的结构简式,G的分子式:C21H23O3N2SBr。
故答案为: 羰基、酯基;C21H23O3N2SBr;
(2)A是CH3COOC2H5在NaH作用下生成B![]() ,B与SO2Cl2发生取代反应生成C
,B与SO2Cl2发生取代反应生成C ,A→B和B→C的反应类型分别为:取代反应,取代反应。根据质量守恒,两分子A生成B和另一种产物,该产物结构简式为:CH3CH2OH。
,A→B和B→C的反应类型分别为:取代反应,取代反应。根据质量守恒,两分子A生成B和另一种产物,该产物结构简式为:CH3CH2OH。
故答案为:取代反应; 取代反应;CH3CH2OH;
(3)D与氨基甲烷反应生成E 和水,D生成E的反应方程式:
和水,D生成E的反应方程式: 。
。
故答案为: ;
;
(4)F与HCHO和二甲基氨生成产品G ,H的结构简式为:NH(CH3)2 或
,H的结构简式为:NH(CH3)2 或![]() 。
。
故答案为:NH(CH3)2 或![]() ;
;
(5)①与碳酸氢钠反应产生使澄清石灰水变浑浊的气体,结构中有羧基,—COOH, ②六元环状结构,分子中总共有6个碳,羧基一个碳,六元环中有一个氧原子,B![]() 的同分异构体中具有满足下列条件的结构简式:
的同分异构体中具有满足下列条件的结构简式: 。
。
故答案为: ;
;
(6)结合上述合成路线,由乙醇和![]() 为基本原料,逆合成分析,要合成
为基本原料,逆合成分析,要合成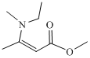 先合成乙酸乙酯,原料中有乙醇,要合成乙酸。
先合成乙酸乙酯,原料中有乙醇,要合成乙酸。 ;
;
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为________。
(2)用如图装置可以测定混合气中ClO2的含量:
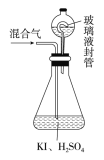
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为__________,反应中ClO2为_______剂(氧化或还原)。
②玻璃液封装置的作用是__________。
③Ⅴ中加入的指示剂通常为________,滴定至终点的现象是___________。
④测得混合气中ClO2的质量为________g。
(3)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是________(填标号)。
a明矾b碘化钾c盐酸d硫酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.
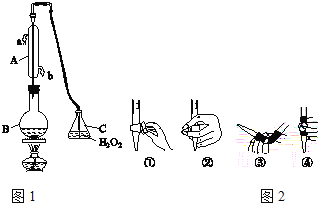
(1)仪器A的名称是_____,水通入A的进口为_____。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_____(填数字编号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_____;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:_____g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出 As 的基态原子的电子排布式_____。
(2)将 NaNO3 和 Na2O 在一定条件下反应得到一种白色晶体,已知其中阴离子与 SO42-互为等 电子体,则该阴离子的化学式是_____。
(3)Fe3+、Co3+与 N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验 Fe2+,配体 CN-中碳原子杂化轨道类型为_____。
②[Co(N3)(NH3)5]SO4 中 Co 的配位数为_____,其配离子中含有的化学键类型为___(填离子键、共价键、配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关117号元素Ts(中文名“![]() ”,tiǎn)的说法不正确的是( )
”,tiǎn)的说法不正确的是( )
A.基态Ts原子的电子所在最高电子层的符号是Q
B.基态Ts原子有一个未成对电子
C.Ts的电负性在同周期主族元素中最大
D.基态Ts原子有7种能量不同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ΔH=-akJ/mol
ΔH=-akJ/mol
下列说法中正确的是( )
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯分子比反-2-丁烯分子能量低
C.高温有利于生成顺-2-丁烯
D.等物质的量的顺-2-丁烯和反-2-丁烯分别与足量氢气反应,放出的热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
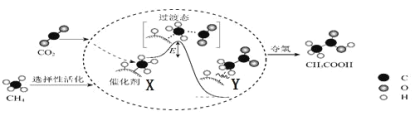
①在合成CH3COOH的反应历程中,下列有关说法正确的是_____。(填字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为_____。
II.电解法转化CO2制HCOOH的原理如图。

①写出阴极CO2还原为HCOO-的电极反应式:_____。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____。
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_____。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比![]()
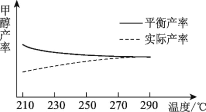
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH____0(填“>”或“<”),其依据是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
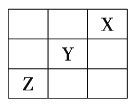
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com