
【题目】关于下列转化过程分析不正确的是

A.Fe3O4 中 Fe 元素的化合价为+2、+3
B.过程Ⅰ中每消耗 58 g Fe3O4 转移 1 mol 电子
C.过程Ⅱ的化学方程式为 3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为 2H2O═2H2↑+O2↑
【答案】B
【解析】
A.Fe3O4的化学式可以改写为Fe2O3FeO,Fe3O4中Fe元素的化合价为+2、+3,故A正确;
B.过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g)当有2molFe3O4分解时,生成1mol氧气,而58g Fe3O4的物质的量为0.25mol,故生成0.125mol氧气,而氧元素由-2价变为0价,故转移0.5mol电子,故B错误;
C.过程Ⅱ中FeO与水反应生成四氧化三铁和氢气,反应化学方程式为3FeO+H2O![]() Fe3O4+H2↑,故C正确;
Fe3O4+H2↑,故C正确;
D.过程Ⅰ:2Fe3O4(s)==6FeO(s)+O2(g)过程II:3FeO(s)+H2O(l)==H2(g)+Fe3O4(s),相加可得该过程总反应为2H2O==O2↑+2H2↑,故D正确;
故选:B。


科目:高中化学 来源: 题型:
【题目】在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
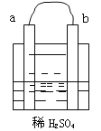
A. 碳棒上有气体放出,溶液的pH增大
B. 导线中有电子流动,电子从a极流到b极
C. a是正极,b是负极
D. a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g) + B(g) xC(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )
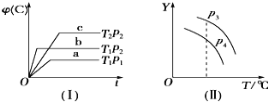
A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A |
| Cu从 |
B | 节日燃放的五彩缤纷的烟花 | 碱金属以及锶、钡等金属化合物的焰色反应 |
C | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝的熔点低于铝的熔点 |
D | 氢氟酸可用于蚀刻玻璃 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴,并制备金属锂。
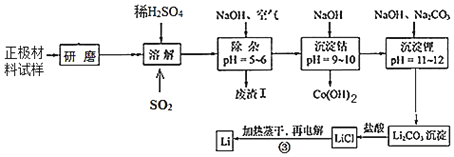
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)LiCoO2中,Co元素的化合价为_____。
(2)上述流程中为加快化学反应速率而采取的措施是_____。
(3)在上述溶解过程中,通入SO2的目的为_____。
(4)加NaOH调pH的目的是_____。
(5)写出“沉钴”过程中发生反应的离子方程式_____。
(6)洗涤所得Li2CO3沉淀要使用_____(填“热水”或“冷水”),将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是_____。
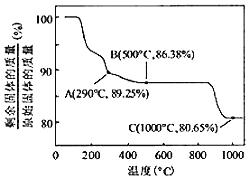
(7)Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中有错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线上
C.用酒精萃取碘水溶液中的碘
D.称量时,称量物放在称量纸上或烧杯中,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质、混合物的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | NaCl |
|
|
弱电解质 |
|
|
|
|
非电解质 | 蔗糖 |
| 苯 |
|
混合物 | 碱石灰 | 胆矾 | 碘酒 | 液氯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-
Fe(SCN)3+3KCl,离子方程式为:Fe3++3SCN-![]() Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
Fe(SCN)3,达到平衡后,进行下列操作,平衡怎样移动?
(1)加入少量FeCl3固体:平衡向____________移动;
(2)加入少量KSCN固体:平衡向____________移动;
(3)加入少量KCl固体:平衡____________移动,其理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。
(1)氨气属于共价型氢化物,工业常用氨气和醋酸二氨合铜[Cu(NH3)2]Ac的混合液来吸收CO(醋酸根离子简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3CO]Ac
①氨水溶液中各元素原子的第一电离能从大到小排列顺序为___________。
②醋酸分子(CH3COOH)中的两个碳原子的杂化方式分别是_________________。
③生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________(填序号)。
A.离子键b.金属键c.共价键d.配位键
(2)某离子化合物XY2,晶胞结构如图所示,其中6个Y原子用数字1~6标注。
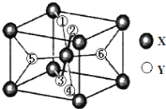
已知1、2、3、4号Y原子在晶胞上、下面上,则5、6号Y原子均在晶胞_________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY2晶体的熔沸点______(填“>”、“=”或“<”)固态氨的熔沸点。
③若该晶胞的边长为anm,密度为ρg/cm3,XY2的摩尔质量为Mg/mol,则阿伏加德罗常数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com