
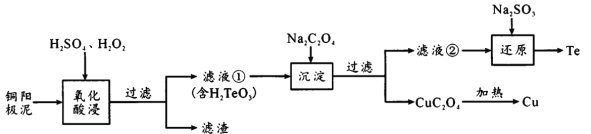
����Ŀ�����Ƿ�չ�߿Ƽ���ҵ���������˼������ɻ�ȱ��ԭ�ϡ�H2TeO3��һ�ֱȲ����������Ķ�Ԫ�ᣬ��ҵ�ϳ���ͭ������[��Ҫ�ɷ����ڻ���ͭ(Cu2Te)����������Ag��Au]�����ڣ��乤���������£�
��֪��CuC2O4��KspΪ2.2��10-8������Ũ��С��1��10-5mol/Lʱ����������ȫ������
(1)Cu2Te��Te�Ļ��ϼ���___��
(2)�����ijɷ���___����Һ���к��е��������ʱ��������Ϊ____���������ʱ�¶ȹ���ʹ�ڵĽ����ʽ��ͣ�ԭ����_______��
(3)��ҪʹCu2+��ȫ������Ӧ����C2O42-��Ũ�Ȳ�����_____��
(4)��ԭ��Ӧ�����ӷ���ʽΪ______________��
���𰸡�-2 Ag��Au H2TeO3��CuSO4 �¶ȹ���H2O2�ֽ����࣬ʹ������������ 2.2��10-3mol/L H2TeO3+2SO32-=2SO42- +Te��+H2O
��������
ͭ���������Ҫ�ɷ�ΪCu2Te����������Ag��Au����ϡ�������ܽ⣬������������⣬�õ�H2TeO3��Au��Ag������ͭ��Һ��Ȼ����ˣ���Һ�ٺ�������ͭ��H2TeO3�������к���Au��Ag������Һ���м�������ƣ�H2TeO3��һ�ֱȲ����������Ķ�Ԫ�ᣬ������������ͭ��Ӧ���ɲ���ͭ���������ˣ�����Ϊ����ͭ������ֽ�����ͭ����Һ���к���H2TeO3�������ƣ���������������Һ���ɽ���Һ�е�H2TeO3��ԭΪTe��ͬʱ�õ������ƣ��ݴ˷������
(1)Cu2Te������Ϊ�ڻ���ͭ����Cu�Ļ��ϼ�Ϊ+1�ۣ����Te�Ļ��ϼ���-2���ʴ�Ϊ��-2��
(2)�������������������ijɷ���Ag��Au����Һ���к��е��������ʱ��������ΪH2TeO3��CuSO4���¶ȹ���H2O2�ֽ����࣬ʹ�����������֣������������ʱ�¶ȹ���ʹ�ڵĽ����ʽ��ͣ��ʴ�Ϊ��Ag��Au��H2TeO3��CuSO4���¶ȹ���H2O2�ֽ����࣬ʹ�����������֣�
(3) CuC2O4��KspΪ2.2��10-8������Ũ��С��1��10-5mol/Lʱ�����Ӽ���ȫ��������ҪʹCu2+��ȫ������Ӧ����C2O42-��Ũ�Ȳ�����![]() =2.2��10-3mol/L���ʴ�Ϊ��2.2��10-3mol/L��
=2.2��10-3mol/L���ʴ�Ϊ��2.2��10-3mol/L��
(4) ��������������Һ���ɽ���Һ�е�H2TeO3��ԭΪTe��ͬʱ�õ������ƣ���ԭ��Ӧ�����ӷ���ʽΪH2TeO3+2SO32-=2SO42- +Te��+H2O���ʴ�Ϊ��H2TeO3+2SO32-=2SO42- +Te��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiԪ�������������������Ź㷺��Ӧ�á��ش���������:
(1)��̬Niԭ�Ӽ۲���ӵ��Ų�ʽΪ_______��
(2)��ѧ�����о�������������ֵĹ����У�������Cu-Ni-Fe�ȶ��ֽ��������ȷ��ij�ֽ����������Ǿ��廹�ǷǾ�����ɿ��Ŀ�ѧ�����ǶԹ������______��
(3)Ni������±��(SCN)2��Ӧ����Ni(SCN)2��Ni(SCN)2�У���һ����������Ԫ����____��(SCN)2�����У���ԭ�ӵ��ӻ���ʽ��___��������������Ŀ֮��Ϊ_____��
(4)[Ni(NH3)6](NO3)2�У������ڵĻ�ѧ��Ϊ_____(����)��
a�����Ӽ� b�������� c����λ�� d�����
(5)����CO��N2���۷е�ߵ�ԭ��___��
(6)���Ͻ�����о���ȡ�úܴ��չ��
��ͼ����һ�������Ͻ����ľ����ṹʾ��ͼ���úϽ����1 mol La�ĺϽ������H2����ĿΪ___��
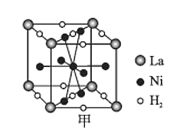
��Mg2NiH4��һ������Ľ����⻯���Mg2NiH4�����У�Niԭ��ռ����ͼ�ҵĶ�������ģ�Mg2+������ͼ�˸�С����������ġ�Mg2+λ��Niԭ���γɵ�___�������������϶�������������϶��������������ܶ�Ϊd g/cm3��Mg2NiH4��Ħ������ΪM g/mol����Mg2+��Niԭ�ӵ���̾���Ϊ___nm(�ú�d��M��NA�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ӵ������������Ҫ���Ƚϸߵ������̣�Ŀǰ��ҵ������������(�ơ�þ������)�����ߣ�������ͼ���̿���ȡ���Ƚϸߵ���������Һ��

��Ӧ��ʹ�������ɷ�����ij������Է�Ӧ��ǰ������ʺ��������(��350g/LMnSO4��)���£�
���� | ����ǰ/g | ������/g | ȥ����/% |
Fe2+��Fe3+ | 0.001275 | 0.001275 | �� |
Ca2+ | 0.490000 | 0.021510 | 95.61 |
Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)����x��������_____��
(2)�Է�����þȥ�������ͬ��ԭ��_____��
(3)����Һ�м���KMnO4���Խ�Fe2+����ΪFe3+��ͬʱ����Mn2+���÷�Ӧ�����ӷ���ʽΪ_____��
(4)��֪�������������������pH
Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
��ʼ����ʱ | 6.3 | 1.5 | 8.3 |
��ȫ����ʱ | 8.3 | 2.8 | 9.8 |
ע���������ӵ���ʼŨ��Ϊ0.1mol/L
���ݱ������ݽ��������Тڵ�Ŀ�ģ�_____��
(5)��һ���о������������Ӧ�ٺ���ֱ�Ӽ���KMnO4��ͬʱ���Ƽ����������Ӧ�����pH��Ȼ���ٹ��ˣ����Խ�һ����߸�þ��ȥ���ʣ���þȥ������ߵ�ԭ�������¼��裺
����I��Fe2+��������Fe3+��Fe3+ˮ�����ɵ�Fe(OH)3�����˳����
����II��Mn2+�뷴Ӧ���ɵĻ���MnO2�����˳����
ѡ���ʵ������Լ������ʵ����֤�����Ƿ����____________________��
(6)����ӵ�س�ŵ�����У����������������֮�������ƶ�������һ��ҡ�Σ�����ҡ��ʽ����������͵�����ӵ�ع���ԭ����ͼ��ʾ��

�ٷŵ�ʱLi+���ƶ������__________������_____(����a������b��)��
����֪�缫�ܷ�Ӧ��LiCoO2+C![]() Li1��xCoO2+CLix��д���ŵ�ʱ�����ĵ缫��Ӧʽ__��
Li1��xCoO2+CLix��д���ŵ�ʱ�����ĵ缫��Ӧʽ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������ǵ�����������ʡ�
(1)�γ������ԭ��֮һ�ɼ�ʾ���£�
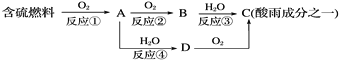
�ش��������⣺
�������pH________(���������������=��)5.6��
��D���ʵĻ�ѧʽΪ____________��
�۷�Ӧ�ڵĻ�ѧ����ʽΪ_________________________________________��
(2)��һ�������°��������������������ת��Ϊ����Ⱦ�����ʡ�д�������Ͷ���������һ�������·�Ӧ�Ļ�ѧ����ʽ��__________________����Ӧ����������____________����ԭ����_______________��
(3)������������Һ�������շ����еĵ��������Ӧ�Ļ�ѧ����ʽ���£�
NO2+NO+2NaOH===2NaNO2+H2O��2NO2+2NaOH===NaNO2+NaNO3+H2O
����VLijNaOH��Һ����ȫ����n molNO2��m molNO��ɵĴ�����Ⱦ�
�������ռ���Һ�����ʵ���Ũ������Ϊ________ mol��L1��
����������Һ��c(NO3��)��c(NO2��)=1��9����ԭ���������NO2��NO�����ʵ���֮��n��m=______��
���ú�n��m�Ĵ���ʽ��ʾ������Һ��NO3����NO2��Ũ�ȵı�ֵc(NO3��)��c(NO2��)=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С���������ʵ�飺
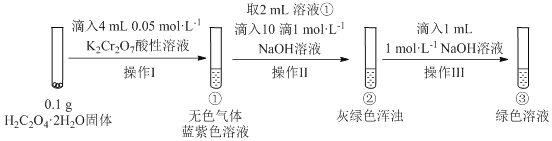
��֪��Cr2(SO4)3ϡ��ҺΪ����ɫ��Cr(OH)3Ϊ����ɫ���壬������ˮ�����й��ڸ�ʵ��Ľ��ۻ���������ȷ����
A.������������ɫ��Һ˵��K2Cr2O7�ڷ�Ӧ�б�����������
B.����II�н�������Ӧ��Cr3++3OH-�TCr(OH)3��
C.���������Һ�������ϻ��������ɫ���ǣ���������Cr3+��ˮ��ƽ���ƶ��й�
D.����������м���ϡ���ᣬ��Һ�п������±������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ��Ʊ�װ�á��Ʊ�ʱʹ�õ�ԭ�����ռ���������ȷ���ǣ� ��
��� | ���� | �Ʊ�װ�� | �Ʊ�ʱʹ�õ�ԭ�� | �ռ����� | ��� | ���� | �Ʊ�װ�� | �Ʊ�ʱʹ�õ�ԭ�� | �ռ����� |
A |
|
|
| ��ˮ�� | B | NO |
| Ũ����ͽ���ͭ | �ſ����� |
C |
|
| Ũ��ˮ���������ƹ��� | �ſ����� | D |
|
| �Ҵ��� | ��ˮ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ����ģ��ش����⡣
ƽ�����»��Ļʽ�ϣ���2022����Լ���������ձ����̺��˷ḻ���й��Ļ���չ������ʱ���й�����


��èľż����èľż��2.35m��������Ϊ10kg�������Ͻ�ܲĺ�̼��ά������ܣ����LED���������ɡ����У�̼��ά�Ǻ�̼������90%�����Ͳ��ϣ��ܶȱ���С��ǿ�ȱȸִ�
���ܻ����ˣ��й���һ�����ܻ��������ֻ����߹��衢�������ڵ������ԡ����������Ժ�����Եȷ��棬ʵ�����˹�����������������¡�
ʯīϩ���ܷ��ȷ����������ܷ��ȷ�����20��������³�������4h��ʯīϩ��һ����̼ԭ�ӹ��ɵ������Ͷ�ά̼���ײ��ϣ����г���Ӳ�ȡ�ǿ�Ⱥ͵���ϵ�������ԡ�
���������϶��ģ��ж�����˵���Ƿ���ȷ����������������������
��1����èľż�����ܻ����ˡ�ʯīϩ���ܷ��ȷ�չ�������й��ǻ�����_____��
��2��̼��ά�������������ܣ����й㷺��Ӧ��ǰ����_____��
��3���й���һ�����ܻ������ڶ����������ȷ���ʵ�����˹�����������������¡�_____��
��4��ʯīϩ��ʯī��ͬ��Ԫ����ɣ������ǵ��������ʲ���ϴ�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��д��ȷ���ǣ� ��
A. CaCO3�ĵ��뷽��ʽ��CaCO3 ![]() Ca2+��CO32��
Ca2+��CO32��
B. H2SO3�ĵ��뷽��ʽH2SO3![]() 2H����SO32��
2H����SO32��
C. CO32����ˮ�ⷽ��ʽ��CO32����2H2O![]() H2CO3��2OH��
H2CO3��2OH��
D. HCO3����ˮ��Һ�еĵ��뷽��ʽ��HCO3����H2O![]() H3O����CO32��
H3O����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư��(����һ�����ȷ�Ӧ)����ش��������⣺
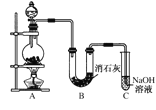
��1��AΪʵ�����������ķ���װ�ã���Ӧ��ѧ����ʽΪ_________________________��ijѧ����12 mol��L��1��Ũ����100 mL��������MnO2��Ӧ��Cl2��ʵ�ʵõ���Cl2________6.72 L(����<������>����������)��
��2��Ư�۽���U�ι��в������仯ѧ����ʽ��_________________________________��
��3����ʵ������Ư�۵���Ч�ɷ�ƫ�͡���ѧ�����������������Ϸ��֣���Ҫԭ������U�ι��л�������������Ӧ��
���¶Ƚϸ�ʱ��������ʯ�ҷ�Ӧ����Ca(ClO3)2��Ϊ����˸���Ӧ�ķ������ɲ�ȡ�Ĵ�ʩ��________________��
��Cl2�к�HCl���ᷢ����Ӧ2HCl��Ca(OH)2===CaCl2��2H2O��Ϊ����˸���Ӧ�ķ������ɽ�װ�����θĽ�______________________________��
��4�� Cװ�õ�������________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com