
【题目】下列物质的用途利用其化学性质的是
A. 铜用于制作导线B. 用汽油去除衣服上的油污
C. 盐酸除铁锈D. 浓硫酸用作干燥剂
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】A为我国产量最大的金属单质,根据图示的关系回答下列问题
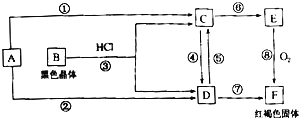
(1)写出化学式:B为 __________________,E为 _________________。
(2)反应 ①至⑧中,属于非氧化还原反应的是为 :_____________________(填序号)。
(3)反应③的离子方程式为 :________________________________________________________ 反应⑤的离子方程式为 :_________________________________________________________ 反应⑥的离子方程式为 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.
(1)工业上可用Cu2S+O2 ![]() 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 .
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 .
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2 , 反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃﹣60℃的两个原因除了加快反应速率外,还有 . 在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 .
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成.
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:Cu+H2SO4 ![]()
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是(填字母)
a Cu2S和CuS都是黑色的
b 铜与浓硫酸在加热条件下反应,还可能放出O2
c 浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1L 0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到2240mL NO气体(标准状况).Cu2O跟稀硝酸反应的离子方程式 . 若将上述混合物用足量的H2加热还原,所得到固体的质量为g.若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室中制备气体或者验证气体性质的装置图 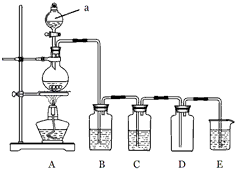
(1)写出用A制取氯气的化学方程式
(2)利用图中装置制备纯净、干燥的氯气,并证明氧化性:Cl2>Fe3+装置B中的溶液的作用为;装置D中加的最佳试剂为(填序号) .
供选试剂:a、浓硫酸 b、FeCl2溶液 c、KSCN与FeCl2的混合溶液 d、无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具有氧化性和漂白性:B中为少量Na2S溶液、C中为品红溶液,D中应加入足量的(填溶液名称),E中加入溶液(填化学式)
(4)证明碳元素的非金属性比硅元素的强的现象为 , 实验2不严谨之处应如何改进
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(molL﹣1)随反应时间(min)的变化情况如下表:
时间 | 1 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为molL﹣1min﹣1
(2)实验2中,A的初始浓度c2=molL﹣1 , 反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的化学反应速率为v3 , 实验1的化学反应速率为v1 , 则v3v1(填“>”“=”或“<”),且c31.0molL﹣1(填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应的正反应是反应(填“吸热”或“放热”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18 g H2O含有10NA个质子
B.7.8 g Na2O2中含有的阴离子数是0.2NA
C.标准状况下,22.4 L氨水含有NA个NH3分子
D.56 g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.用石墨作电极电解AlC13溶液:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
B.酸性高锰酸钾溶液与H2O2溶液混合:2MnO4﹣+3H2O2+6H+═2Mn2++4 O2↑+6H2O
C.向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D.向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br ﹣+2NO3﹣+8H+═3Br2+2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com