
【题目】铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.
(1)工业上可用Cu2S+O2 ![]() 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 .
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 .
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2 , 反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃﹣60℃的两个原因除了加快反应速率外,还有 . 在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 .
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成.
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:Cu+H2SO4 ![]()
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是(填字母)
a Cu2S和CuS都是黑色的
b 铜与浓硫酸在加热条件下反应,还可能放出O2
c 浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1L 0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到2240mL NO气体(标准状况).Cu2O跟稀硝酸反应的离子方程式 . 若将上述混合物用足量的H2加热还原,所得到固体的质量为g.若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
【答案】
(1)1.2NA
(2)防止H2O2分解;2Cu2++2Cl﹣+SO32﹣+H2O ![]() 2CuCl↓+SO42﹣+2H+
2CuCl↓+SO42﹣+2H+
(3)CuO+SO2↑+H2O;ac
(4)3 Cu2O+14 H++2 NO3﹣=6Cu2++2 NO↑+7 H2O;16;0.1 mol
【解析】解:(1)化合价升高的反应为﹣2价的S升高至+4价,所以32gCu2S的物质的量为: ![]() =0.5mol,故反应电子转移数目为:0.5mol×6NAmol﹣1=1.2NA , 所以答案是:1.2NA;(2)因为H2O2在较高温度时更容易分解,所以温度控制在50℃﹣60℃,可以防止H2O2分解;根据氧化还原原理,Cu2+把SO32氧化为SO42,根据原子守恒,反应物除Cu2+、Cl、SO32外,还有H2O,产物还有H+ , 配平得:Cu2++2Cl﹣+SO32﹣+H2O
=0.5mol,故反应电子转移数目为:0.5mol×6NAmol﹣1=1.2NA , 所以答案是:1.2NA;(2)因为H2O2在较高温度时更容易分解,所以温度控制在50℃﹣60℃,可以防止H2O2分解;根据氧化还原原理,Cu2+把SO32氧化为SO42,根据原子守恒,反应物除Cu2+、Cl、SO32外,还有H2O,产物还有H+ , 配平得:Cu2++2Cl﹣+SO32﹣+H2O ![]() CuCl↓+SO42﹣+2H+ ,
CuCl↓+SO42﹣+2H+ ,
所以答案是:防止H2O2分解;2Cu2++2Cl﹣+SO32﹣+H2O ![]() 2CuCl↓+SO42﹣+2H+;(3)①浓硫酸把铜氧化为CuO,本身被还原为SO2 , 同时生成水,所以答案是:CuO+SO2↑+H2O;
2CuCl↓+SO42﹣+2H+;(3)①浓硫酸把铜氧化为CuO,本身被还原为SO2 , 同时生成水,所以答案是:CuO+SO2↑+H2O;
②从物质的颜色判断:Cu2S和CuS的颜色也是黑色的,故a项正确;Cu单质可被氧化为+2价或+1价铜,浓硫酸中的S元素也可被还原为多种低价态,故c项正确,所以答案是:ac;(4)稀硝酸可把+1价Cu氧化为+2价Cu,同时被还原为NO,根据氧化还原规律可写成离子方程式;HNO3的总量为0.6mol,作为氧化剂反应的HNO3被还原为NO,其物质的量为2.24L÷22.L/mol=0.1mol,那么起到酸性作用的HNO3为:0.6mol﹣0.1mol=0.5mol,这部分HNO3转化为了Cu(NO3)2 , 根据元素守恒可知,原化合物中Cu元素的物质的量与起到酸性作用的HNO3的物质的量之比为1:2,H2还原最终得到Cu为:0.5mol÷2×64g/mol=16g;若混合物中含0.1 mol Cu,根据氧化还原反应电子得失总数相等可得:2×0.1mol+2×n(Cu2O)=3×0.1mol,n(Cu2O)=0.05mol,根据题目所给信息Cu2O与稀硫酸反应,溶液呈蓝色,说明生成了Cu2+ , 离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,则0.05mol Cu2O完全反应需要H2SO40.05mol n(CuO)=0.25mol﹣0.1mol﹣2×0.05mol=0.05mol,0.05molCuO 完全反应需要H2SO40.05mol,所以共消耗H2SO4的物质的量为0.1mol,所以答案是:3 Cu2O+14 H++2 NO3﹣=6 Cu2++2 NO↑+7 H2O;16;0.1 mol.


科目:高中化学 来源: 题型:
【题目】韩梅梅体检的血液化验单中,葡萄糖为6.1 mmol/L,表示该体检指标的物理量是:
A. 质量分数(ω) B. 物质的量(n)
C. 摩尔质量(M) D. 物质的量浓度(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3﹣>I﹣ , 氧化性IO3﹣>I2 . 在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( ) 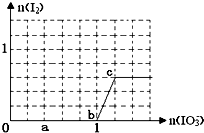
A.0﹣﹣b:3HSO3﹣+IO3﹣=3SO42﹣+I﹣+3H+
B.a点时消耗NaHSO3的物质的量为1.2 mol
C.b﹣c间I2是既是还原产物又是氧化产物
D.当溶液中I与I2的物质的量之比为5:2时,加入的KIO3为1.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业水合碱碳酸镁简称轻质碳酸镁【3MgCO3.Mg(OH)2.3H2O】,相对密度小,质轻而松,广泛用于橡胶制品、防火保湿材料和日货用品中等。一种以富含氯化镁。硫酸镁的卤水和白云石【CaMg(CO3)2】为原料的卤水碳化法生产轻质碳酸镁的工艺流程如下:
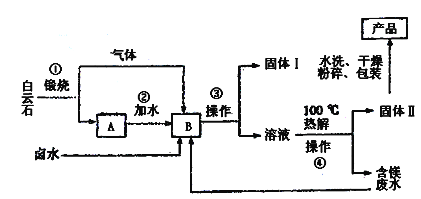
已知:MgCO3比CaCO3更易与CO2反应生成可溶性盐。
(1)为了使第①步白云石煅烧得更充分,常常要对矿石进行__预处理。
(2)第③步和第④步操作的名称是__,在实验室进行该操作时需要的玻璃仪器有
__。
(3)固体I的主要成分为____,固体II的主要成分为____。水洗固体II时,如何判断已经洗净,请简述其过程:____。
(4)写出第④步反应的化学方程式:____。
(5)该流程中能同体现提高效益、减少废物排放思想的两项设计是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述不正确的是
A. 新制氯水长期放置后颜色会逐渐褪为无色
B. 长期放置的氯水也能使有色布条褪色
C. 长期放置的氯水中含有的H+多于新制氯水
D. 新制氯水中含有的阳离子只有 H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物X 转化为Y 和Z的能量变化如图所示.下列说法正确的是( ) 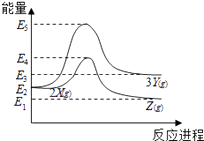
A.由X→Y反应的△H=E5﹣E2
B.由X→Z反应的△H>0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com