
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO42—转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题_______________________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
高温条件下,辉铜矿(主要成分为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。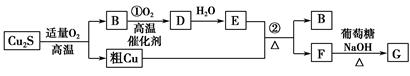
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g)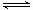 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。[来源:Z|xx|k.Com]
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)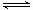 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。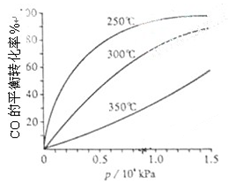
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钛是一种活泼金属,具有密度小、熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用以冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O=H2TiO3↓+H2SO4
③H2TiO3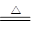 TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2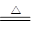 TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg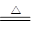 2MgCl2+Ti
2MgCl2+Ti
(1)针对以上五个反应,下列叙述错误的是________。
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
(2)钛具有很强的耐腐蚀性,以下对其原因的分析正确的是________。
A.钛是像金、铂一样的不活泼金属
B.金属钛的表面易形成致密的氧化膜
C.钛与氧气、酸等腐蚀剂不反应
D.钛有很高的强度
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I. 今有H2、Cl2混合气100 mL(标况),其中一种气体的体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为 mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标况,
(1)若仍剩余___mL,证明有___剩余,理由是_____;
(2)若溶液有___性质,证明有___剩余,理由是________________________。
II.一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。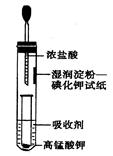
(1)下列溶液能吸收Cl2的是________。
| A.饱和食盐水 | B.Na2SO4溶液 |
| C.NaOH溶液 | D.浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Cu与一定浓度的HNO3反应为:3Cu+2NO3—+xH+ 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。
(1)反应中的x= 。
(2)反应产物R的化学式为 。
(3)参加反应的Cu和消耗HNO3的物质的量之比为 。
(4)1.5 mol Cu完全反应时转移的电子数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
[已知:FeO42-+3e-+4H2O Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如下图: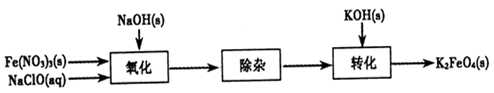
①完成氧化工序的离子方程式: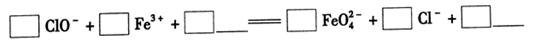
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有_____(写化学式)。
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4_____K2FeO4 (填“>”、“<”或“=”)。
(3)实验室模拟工业电解法制取K2FeO4,装置如右图。
①此装置中电源的负极是____(填“a”或“b”)。
②阳极的电极反应式为______。
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
①由图I可得出的结论:该反应的△H___0(填“>”、“<”或“=”)。
②图Ⅱ中pH1___pH3(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
食盐、碳酸钠和碳酸氢钠是生活中常见的钠盐。请回答下列问题。
(1)碳酸氢钠的水溶液显__________性。(填“酸”、“碱”或“中”)。除去碳酸钠固体中混有的少量碳酸氢钠,反应的化学方程式为_________________。
(2)等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成的CO2量,前者________后者(填“>”、“<”或“=”)。
(3)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等)。用粗盐制取“化学纯”级的NaCl,步骤为溶解、加过量a、加过量NaOH、加过量b、过滤、加适量盐酸,蒸发结晶得到“化学纯”级的NaCl固体。试剂a、b分别是________(填序号)
A.Na2CO3 BaCl2 B.BaCl2 Na2CO3 C.BaCl2 Na2SO4
(4)工业上用电解饱和食盐水的方法生产氯气和烧碱。
①某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理_________________________________(用离子方程式表示)。
②工业上可用氨检验输送氯气的管道是否漏气。反应方程式如下: 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 ________________________________________。
(3)n(KBrO3) = 4时,对应含碘物质的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com