
����Ŀ����ͬ�����£�0.1mol��L-1Na2S2O3��Һ��0.1mol��L-1H2SO4��Һ��5mL����10mLˮ��ϣ���Ӧ����Ϊ��1mol��L-1��s-1��0.2mol��L-1Na2S2O3��Һ��0.2mol��L-1H2SO4��Һ��5mL����30mLˮ��ϣ���Ӧ����Ϊ��2mol��L-1��s-1������1����2�Ĺ�ϵ�ǣ� ��
A.��1>��2B.��1<��2C.��1=��2D.���ܿ϶�
���𰸡�C
��������
�Ƚϻ�Ϻ�Na2S2O3��H2SO4Ũ�ȵĴ�С��Ũ��Խ���ٶ�Խ�졣
0.1mol/L Na2S2O3��Һ��0.1mol/L H2SO4��Һ��5mL����10mLˮ��ϣ���Ϻ�c(Na2S2O3)=c(H2SO4)=![]() =0.025mol/L��
=0.025mol/L��
0.2mol/L Na2S2O3��Һ��0.2mol/L H2SO4��Һ��5mL����30mLˮ��ϣ���Ϻ�c(Na2S2O3)=c(H2SO4)=![]() =0.025mol/L��
=0.025mol/L��
������ҺŨ����ȣ�����ͬ�����·�Ӧ������ͬ������1=��2���ʴ�ΪC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() �� KspΪ
�� KspΪ![]() ��������
��������![]() ��������100mLˮ�����պñ��ͣ��ù�����
��������100mLˮ�����պñ��ͣ��ù�����![]() ��
��![]() Ũ����ʱ��仯��ϵ��ͼ
Ũ����ʱ��仯��ϵ��ͼ![]() ����
����![]() ��Һ�� c(Ag+)=0.034mol/L)���� t
��Һ�� c(Ag+)=0.034mol/L)���� t![]() ʱ����������ϵ�м���100mL0.020mol/L��Na2SO4��Һ������ʾ��ͼ�У�����ȷ��ʾ t
ʱ����������ϵ�м���100mL0.020mol/L��Na2SO4��Һ������ʾ��ͼ�У�����ȷ��ʾ t![]() ʱ�̺�
ʱ�̺�![]() ��
��![]() Ũ����ʱ��仯��ϵ����
Ũ����ʱ��仯��ϵ����![]()
![]()
A.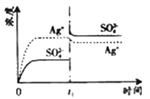 B.
B.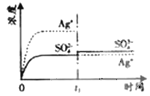
C.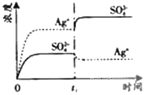 D.
D.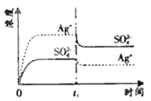
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25�棬101kPa�£�lg C8H18�����飩����Է���������114��ȼ�����ɶ�����̼��Һ̬ˮʱ�ų�48.40kJ��������ʾ������Ӧ���Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A. C8H18��1����25/2O2��g����8CO2��g����9H2O��g������H����48.40kJ��mol��1
B. C8H18��1����25/2O2��g����8CO2��g����9H2O��1������H����5518kJ��mol��1
C. C8H18��1����25/2O2��g����8CO2��g����9H2O��1������H����5518kJ��mol��1
D. C8H18��1����25/2O2��g����8CO2��g����9H2O��1������H����48.40kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��һ��������2SO2(g)��O2(g)![]() 2SO3(g)����H����QkJ��mol��1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ����(����)
2SO3(g)����H����QkJ��mol��1����һ�ܱ������м���2 mol SO2��1 mol O2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2 mol SO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ����(����)
A.Q>Q1>Q2B.Q1>Q2>QC.Q1>Q>Q2D.Q1��Q2>Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ����Ҫ�Ļ���ԭ�ϡ���ʵ�����Ʊ��������£�
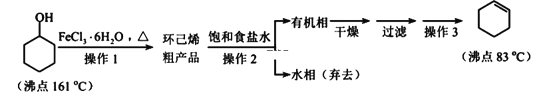
�ش��������⣺
��.����ϩ���Ʊ����ᴿ
(1)ԭ�ϻ������������������ʣ������Լ�Ϊ____________������Ϊ__________________��
(2)����1��װ����ͼ��ʾ(���Ⱥͼг�װ������ȥ)��
����ƿA�н��еĿ��淴Ӧ��ѧ����ʽΪ___________________��Ũ����Ҳ�����÷�Ӧ�Ĵ�����ѡ��FeCl36H2O������Ũ�����ԭ��Ϊ________________(�����)��
a.Ũ������ʹԭ��̿��������SO2
b. FeCl36H2O��ȾС����ѭ��ʹ�ã�������ɫ��ѧ����
c.ͬ�������£���FeCl36H2O��Ũ�����ƽ��ת���ʸ�
������B������Ϊ____________��
(3)����2�õ��IJ���������____________��
(4)������3(����)�IJ��貹�룺��װ����װ�ã��������������ʺͷ�ʯ��____________����ȥǰ��֣��ռ�83�����֡�
��.����ϩ�����IJⶨ
��һ�������£���ag����ϩ��Ʒ�м��붨���Ƶõ�bmolBr2���뻷��ϩ��ַ�Ӧ��ʣ���Br2������KI��������I2����cmolL-1��Na2S2O3����Һ�ζ����յ�ʱ����Na2S2O3����Һvml (�������ݾ��ѿ۳���������)��
�ⶨ�����У������ķ�Ӧ���£�
��Br2+![]() ��
��![]()
��![]()
��![]()
(5)��Ʒ�л���ϩ����������Ϊ___________(����ĸ��ʾ)��
(6)��������ᵼ�²ⶨ���ƫ�͵���____________(�����)��
a.��Ʒ�к��б�������
b.�ڲⶨ�����в��ֻ���ϩ�ӷ�
c. Na2S2O3����Һ���ֱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú��Ϊȼ�Ͽ�ͨ����������;�����������
;����C��s��+O2��g���TCO2��g�� ��H1��0 ��
;�������Ƴ�ˮú����C��s��+H2O��g���TCO��g��+H2��g�� ��H2��0 ��
��ȼ��ˮú����2CO��g��+O2��g���T2CO2��g�� ��H3��0 ��
2H2��g��+O2��g���T2H2O��g�� ��H4��0 ��
��ش��������⣺
��1��;����ų�������������____��������������������������С������;����ų���������
��2��;��������ˮú���ķ�Ӧ���Ӧ�������е�������____�����������е���������������������������������С������������ڷ�Ӧʱ����Ӧ�����Ҫ___��������ת��Ϊ�����
��3��;��I��ͨ����ú����顢�������������ʵ������Ŀ�����ȼ�գ�����������Ŀ����______
��ʹú���ȼ�գ����������ת���� �ڼ���SO2�IJ��������������������
�ۼ����ж���CO������������Ⱦ���� �ܼ���CO2�IJ���������������ЧӦ��
��4����H1����H2����H3����H4����ѧ��ϵʽ��____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú����������������Ŀǰ�о����ȵ㡣
��1����CH4����ԭ��������������������������Ⱦ����֪:
��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574 kJmol-1
��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=-1160 kJmol-1
��H2O(g)=H2O(l) ��H=-44 kJmol-1
д��CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O(l) ���Ȼ�ѧ����ʽ_________��
��2��ij����С���о���������--�����շ�ͬʱ�ѳ�SO2��NO���գ��������̷�Ӧԭ������Ӧ�ȡ�����������£�
��Ӧ��NO(g)+ O3(g) NO2(g)+O2(g) ��H1= -200.9 kJmol-1Ea1= 3.2 kJmol-1
��Ӧ��SO2(g)+ O3(g) SO3(g)+O2(g)��H2= -241.6 kJmol-1 Ea2= 58 kJmol-1
��֪����ϵ�г��������ֽⷴӦ��2O3(g) 3O2(g)����ش�:
�����������䣬ÿ�����ݻ�Ϊ2L�ķ�Ӧ���г��뺬1.0 mol NO��1.0 mol SO2��ģ��������2.0 mol O3���ı��¶ȣ���Ӧ��ͬʱ��t����ϵ��NO��SO2��ת������ͼ��ʾ��
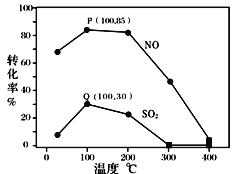
����ͼ��֪��ͬ�¶���NO��ת����Զ����SO2������������ݷ��������ԭ��_______��
������˵����ȷ���� ____________ ��
A��P��һ��Ϊƽ��״̬��
B���¶ȸ���200���NO��SO2��ת�������¶����������½������Ϊ��
C�������������䣬����С��Ӧ�����ݻ������NO��SO2��ת����
�ۼ���100��ʱP��NOת����Ϊ85%����Q��SO2ת����Ϊ30%����Ϊƽ��㣬��ʱ��Ӧʱ��Ϊ10���ӣ������ֽⷴӦ�ij���ռ�������������10%������ϵ��ʣ��O3�����ʵ�����_______mol��NO��ƽ����Ӧ����Ϊ_______________����Ӧ���ڴ�ʱ��ƽ�ⳣ��Ϊ_______________ ��
��3���õ绯ѧ��ģ�ҵ����SO2�������Ṥҵβ���е�SO2ͨ����ͼװ��(�缫��Ϊ���Բ���)����ʵ�飬�������Ʊ����ᣬͬʱ��õ��ܣ�
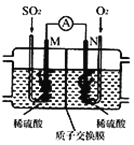
��M�������ĵ缫��ӦʽΪ ____________��
�ڵ����·ͨ��0.2 mol����ʱ�����ӽ���Ĥ������Һ����_____(����������������С��)_______�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У��������з�Ӧ��2A(g)+B(g)+C(g)![]() D(g)+E(g) ��H>0���ﵽƽ�������˵������ȷ���ǣ� ��
D(g)+E(g) ��H>0���ﵽƽ�������˵������ȷ���ǣ� ��
A.�����¶�������£�����һЩϡ�����壬ѹǿ����ƽ�������ƶ�
B.�����¶�ѹ�����£�����C����C��ת���ʽ�����
C.���������£�����ƽ����ϵ��A��������������С
D.�¶ȡ�ѹǿ���ݻ�����ͬʱ������һ�ܱ������м���2molA��1molB��1molC��ƽ��ʱ����������D��E��Ũ�ȷֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH4I�����ܱ������У���һ���¶��·������з�Ӧ��
��NH4I(s)![]() NH3(g)+HI(g)����2HI(g)
NH3(g)+HI(g)����2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
�ﵽƽ��ʱ��c(H2)=0.5mol��L-1��c(HI)=4mol��L-1������¶���,��Ӧ�ٵ�ƽ�ⳣ��Ϊ
A.9B.16C.20D.25
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com