
| 2 |
| 3 |
| 64 |
| 64+16 |
| 1mol/L×0.02L |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 2 |
| 3 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
A、CaCO3
| ||||
| B、CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||||
C、CuO+CO
| ||||
| D、CuO+H2SO4═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | c(一元酸) | c(NaOH)/mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | 0.1 | pH=10 |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol/L | 0.1 | pH=9 |
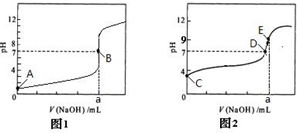
查看答案和解析>>
科目:高中化学 来源: 题型:
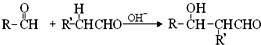 (-R、-R’表示氢原子或烃基)
(-R、-R’表示氢原子或烃基)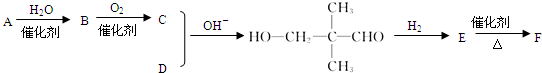
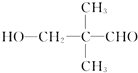 有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为
有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )| A、导线上的电流方向为A→B |
| B、A中SO42-浓度有所减小 |
| C、盐桥中Cl-向A中移动 |
| D、B中铜片质量有所增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com