
| A. | 原子半径:A<D<C<B | |
| B. | 非金属性:C>D | |
| C. | 氢化物的热稳定性:C>A | |
| D. | 单质B常温下能溶于浓硝酸但不能溶于氢氧化钠溶液 |
分析 短周期主族元素A、B、C、D的原子序数依次增大,A原子最外层电子数等于B原子最外层电子数的2倍,则A不可能处于第一周期,A、C的原子序数的差为8,说明A、C同主族,A原子最外层电子数等于B原子最外层电子数的2倍,令B的最外层电子数为x,则A、C最外层电子数为2x,则x+2x+2x=15,解得x=3,故A、C最外层电子数为6,再根据短周期元素A、B、C、D的原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素,据此解答.
解答 解:短周期主族元素A、B、C、D的原子序数依次增大,A原子最外层电子数等于B原子最外层电子数的2倍,则A不可能处于第一周期,A、C的原子序数的差为8,说明A、C同主族,令B的最外层电子数为x,则A、C最外层电子数为2x,则x+2x+2x=15,解得x=3,故A、C最外层电子数为6,再根据短周期元素A、B、C、D的原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径O<Cl<S<Al,故A正确;
B.C为硫元素,D为氯元素,同周期自左而右非金属性增强,故非金属性S<Cl,故B错误;
C.非金属性O>S,故氢化物稳定性:H2O>H2S,故C错误;
D.常温下Al在浓硝酸中发生钝化现象,不能溶于浓硝酸,但Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,故D错误.
故选:A.
点评 本题以周期表中元素的推断为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度.考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力,是高考中的常见题型,试题注重基础,侧重能力的培养.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 相对原子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
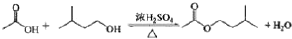
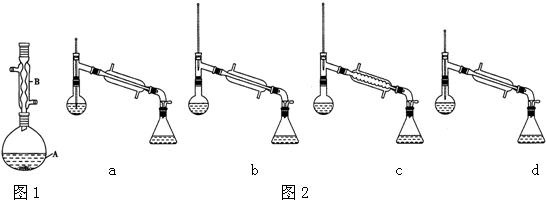
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
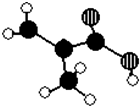 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).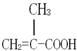 ,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.
,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有3个吸收峰.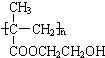 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) |
| 436kJ | akJ | 369kJ |
| A. | 200 | B. | 230 | C. | 260 | D. | 404 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
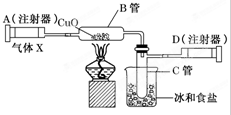 如图所示的实验装置可用来测定含两种元素的气体X的分子式.
如图所示的实验装置可用来测定含两种元素的气体X的分子式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
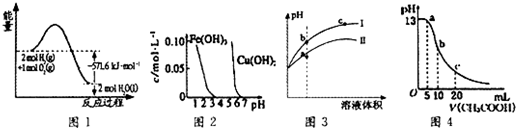
| A. | 图1表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. | 由图2得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. | 图3表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 图4表示常温下向体积为10 mL0.1 mol/LNaOH溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
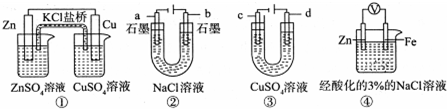
| A. | 装置①中,盐桥中的 K+移向CuSO4溶液 | |
| B. | 装置②在电解过程中,a极上得到22.4 L气体(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) | |
| C. | 可以用装置③在铜上镀银,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com