
【题目】(1)标准状况下,32gCH4和22.4LCO2的密度之比为_______;物质的量之比为______。
(2)将20gNaOH溶于水得2L溶液,则该NaOH溶液的物质的量浓度为_________;若从中取出100mLNaOH溶液,其中含有的Na+与____molNa2CO3含有的Na+数目相同。
(3)已知标准状况下,现有四种物质:
A.49g H2SO4 B.6.02×1023个H2O C.44.8L CO和CO2混合气体 D.6g H2
其中所含分子物质的量最小的是____________(填字母);所占体积最大的是________(填字母);若C中气体重量为64g,则该混合气体中CO和CO2的体积比为__________________。
(4)标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρ g·mL-1,则所得盐酸溶液中溶质的物质的量为________________,溶液的物质的量浓度为__________。
【答案】4:11 2:1 0.25mol/L 0.0125 A D 3:1 ![]() mol
mol ![]() mol/L
mol/L
【解析】
(1)根据![]() 比较,把物质的质量、体积都转化为物质的量,求比值;
比较,把物质的质量、体积都转化为物质的量,求比值;
(2)根据n=![]() 及c=
及c=![]() 计算溶液的物质的量浓度,利用n=cV计算NaOH溶液中含有的Na+的物质的量,结合Na2CO3的组成确定其物质的量;
计算溶液的物质的量浓度,利用n=cV计算NaOH溶液中含有的Na+的物质的量,结合Na2CO3的组成确定其物质的量;
(3)将选项的物理量都转化为物质的量,然后根据N=nNA判断;假设C中混合气体中CO、CO2的物质的量分别是x、y,根据二者的质量与体积关系计算;
(4)根据n=![]() 计算溶质的物质的量,根据m=ρV计算溶液的质量,结合溶质的质量得到溶液中溶质的质量分数,在利用c=
计算溶质的物质的量,根据m=ρV计算溶液的质量,结合溶质的质量得到溶液中溶质的质量分数,在利用c=![]() 计算溶液的物质的量浓度。
计算溶液的物质的量浓度。
(1)根据![]() 可知CH4和CO2的密度之比等于它们的相对分子质量之比,为16:44=4:11;32gCH4的物质的量为n(CH4)=32g÷16g/mol=2mol,在标准状况下22.4LCO2的物质的量n(CO2)=22.4L÷22.4L/mol=1mol,所以n(CH4):n(CO2)=2mol:1mol=2:1;
可知CH4和CO2的密度之比等于它们的相对分子质量之比,为16:44=4:11;32gCH4的物质的量为n(CH4)=32g÷16g/mol=2mol,在标准状况下22.4LCO2的物质的量n(CO2)=22.4L÷22.4L/mol=1mol,所以n(CH4):n(CO2)=2mol:1mol=2:1;
(2)20gNaOH的物质的量n(NaOH)=![]() =0.5mol,将其溶于水得2L溶液,则该NaOH溶液的物质的量浓度c=
=0.5mol,将其溶于水得2L溶液,则该NaOH溶液的物质的量浓度c=![]() =0.25mol/L;若从中取出100mLNaOH溶液,其中含有的NaOH的物质的量为0.25mol/L×0.1L=0.025mol,根据NaOH的组成可知其中含有的Na+是0.025mol,由于1个Na2CO3电离产生2个Na+。所以Na+为0.025mol,则需Na2CO3的物质的量为0.0125mol;
=0.25mol/L;若从中取出100mLNaOH溶液,其中含有的NaOH的物质的量为0.25mol/L×0.1L=0.025mol,根据NaOH的组成可知其中含有的Na+是0.025mol,由于1个Na2CO3电离产生2个Na+。所以Na+为0.025mol,则需Na2CO3的物质的量为0.0125mol;
A.49g H2SO4的物质的量为n(H2SO4)=49g÷98g/mol=0.5mol;
B.6.02×1023个H2O的物质的量为n(H2O)=6.02×1023 ÷6.02×1023/mol=1mol;
C.44.8L CO和CO2混合气体的物质的量n=44.8L÷22.4L/mol=2mol;
D.6g H2的物质的量n=6g÷2g/mol=3mol
可见物质的量最小的是H2SO4,根据N=nNA可知,物质的量越小,其中含有的分子数目越少,所以其中所含分子物质的量最小的选项是A。在上述物质中,水、硫酸为液体物质,CO和CO2的混合气体及H2都是气体,气体分子间隔大,等物质的量的物质体积也大,则所占体积最大的是H2,选项为D;
假设C中混合气体中CO、CO2的物质的量分别是x mol、y mol,则x+y=2,28x+44y=64,解得x=1.5,y=0.5,则根据V=nVm可知二者的体积比等于它们的物质的量的比,故V(CO):V(CO2)=1.5:0.5=3:1;
(4)标准状况下,aLHCl气体的物质的量n(HCl)=![]() mol,HCl的质量是m(HCl)=nM=
mol,HCl的质量是m(HCl)=nM=![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g;标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρg·mL-1,溶液的质量是m(溶液)=
g;标准状况下,将aLHCl完全溶于100mL水,假设该溶液的密度为ρg·mL-1,溶液的质量是m(溶液)=![]() g+100g=
g+100g=![]() g,则溶质的质量分数为:
g,则溶质的质量分数为: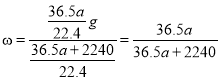 ;则根据物质的量浓度与质量分数换算式可得该盐酸溶液的物质的量浓度c=
;则根据物质的量浓度与质量分数换算式可得该盐酸溶液的物质的量浓度c=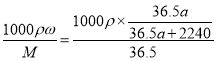 mol/L=
mol/L=![]() mol/L。
mol/L。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NaOH的摩尔质量为40g
B.22.4 L气体所含分子数一定大于11.2 L气体所含的分子数
C.标准状况下,1 mol任何物质的体积都约为22.4 L
D.标准状况下,1 mol 由O2和N2按任意比组成的混合气体的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键线式是表达有机化合物结构的一种方式,如H2N-CH2-CH2-OH用键线式可以表达为![]()
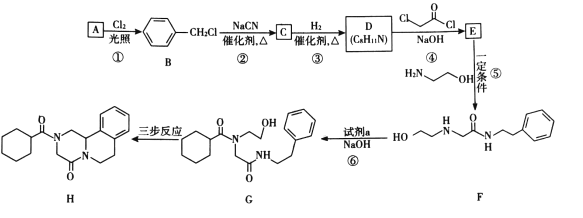
吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
已知i.R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii.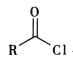 +R′-NH-R″+NaOH
+R′-NH-R″+NaOH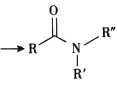 +NaCl+H2O
+NaCl+H2O
(1)A属于芳香烃,其名称是____。
(2)②的反应类型是____。
(3)B的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为____。
(4)③中1 mol C理论上需要消耗____mol H2生成D。
(5)④的化学方程式是____。
(6)F中含氧官能团是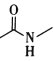 和____。
和____。
(7)试剂a的结构简式是____。
(8)G→H分为三步反应,J中含有3个六元环,写出I、J的结构简式______、______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断:( )

A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、Na2SO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.

(1)锥形瓶A内所盛试剂是__________;装置B的作用是__________;锥形瓶D内发生反应的离子方程式为__________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为__________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法__________;该黄铜矿中硫元素的质量分数为__________(用含m1、m2的代数式表示).
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________
A.KSCN溶液、氯水B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+.设计实验方案验证泡铜中是否含有Cu2O__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据有机化合物分子中所含官能团,可对其进行分类和性质预测。
①下列有机化合物属于醇类物质的是____(填字母)。
a.CH3CH2OH b.CH3CHO c.![]()
②下列有机化合物中加入浓溴水能生成白色沉淀的是____(填字母)。
a.CH2=CH2 b.苯 c.![]()
③下列有机化合物能发生水解反应的是____(填字母)。
a.乙酸 b.油脂 c.葡萄糖
(2)有机物W(![]() )广泛存在于肉桂类植物的果肉中。
)广泛存在于肉桂类植物的果肉中。
①W分子中所含官能团的名称为____和____。
②W分子中处于同一平面的碳原子最多有____个。
③1mol W分子最多能与____mol H2发生加成反应。
(3)对羟基苯甲酸乙酯( )是常用的食品防腐剂,可通过以下方法合成:
)是常用的食品防腐剂,可通过以下方法合成:
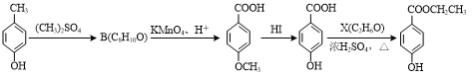
A C D E
①C→D的反应类型为____。
②B的结构简式为____。
③D与碳酸氢钠反应后所得有机物的结构简式为____。
④D→E反应的化学方程式为____。
⑤写出同时满足下列条件的C的一种同分异构体的结构简式:____。
Ⅰ.能和FeCl3溶液发生显色反应;
Ⅱ.能发生银镜反应,不能发生水解反应;
Ⅲ.分子中含有4种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分矿物资源铝土矿(主要含有氧化铝、氧化铁)和黄铜矿(主要成分CuFeS2)的利用及产品生产流程,有关说法不正确的是( )
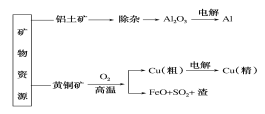
A. 除杂过程中铝元素的存在形式的变化可以如下:Al2O3→AlO2-→Al(OH)3→Al2O3
B. Al和Cu(精)均在电解槽的阴极获得
C. 粗铜炼制过程中反应2CuFeS2+O2![]() Cu2S+2FeS+SO2,每转移1.2mol电子,则有0.2mol硫被氧化
Cu2S+2FeS+SO2,每转移1.2mol电子,则有0.2mol硫被氧化
D. 若电解法分别制铝和铜的过程中转移电子数相等,理论上获得的铝和铜的物质的量之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com