
ΓΨΧβΡΩΓΩΦϋœΏ Ϋ «±μ¥ο”–ΜζΜ·ΚœΈοΫαΙΙΒΡ“Μ÷÷ΖΫ ΫΘ§»γH2N-CH2-CH2-OH”ΟΦϋœΏ ΫΩ…“‘±μ¥οΈΣ![]()
ΏΝύ≠ΆΣ(H) «“Μ÷÷÷ΈΝΤ―ΣΈϋ≥φ≤ΓΒΡ“©ΈοΘ§Κœ≥…¬ΖœΏ»γœ¬ΆΦΥυ ΨΘΚ
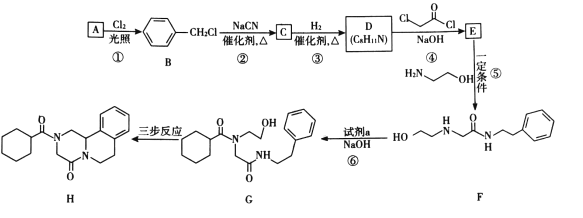
“―÷Σi.R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii.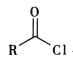 +RΓδ-NH-RΓε+NaOH
+RΓδ-NH-RΓε+NaOH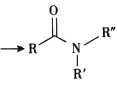 +NaCl+H2O
+NaCl+H2O
(1)A τ”ΎΖΦœψΧΰΘ§ΤδΟϊ≥Τ «____ΓΘ
(2)ΔΎΒΡΖ¥”Πάύ–Ά «____ΓΘ
(3)BΒΡ“Μ÷÷Ά§Ζ÷“λΙΙΧεΘ§Κ§±ΫΜΖ«“ΚΥ¥≈Ι≤’ώ«βΤΉ÷–≥ωœ÷»ΐΉιΖεΘ§ΤδΫαΙΙΦρ ΫΈΣ____ΓΘ
(4)Δέ÷–1 mol Cάμ¬έ…œ–η“ΣœϊΚΡ____mol H2…ζ≥…DΓΘ
(5)ΔήΒΡΜ·―ßΖΫ≥Χ Ϋ «____ΓΘ
(6)F÷–Κ§―θΙΌΡήΆ≈ «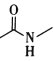 ΚΆ____ΓΘ
ΚΆ____ΓΘ
(7) ‘ΦΝaΒΡΫαΙΙΦρ Ϋ «____ΓΘ
(8)GΓζHΖ÷ΈΣ»ΐ≤ΫΖ¥”ΠΘ§J÷–Κ§”–3ΗωΝυ‘ΣΜΖΘ§–¥≥ωIΓΔJΒΡΫαΙΙΦρ Ϋ______ΓΔ______ΓΘ

ΓΨ¥πΑΗΓΩΦΉ±Ϋ »Γ¥ζΖ¥”Π ![]() 2
2  τ«ΜυΘ®Μρ-OHΘ©
τ«ΜυΘ®Μρ-OHΘ©  IΘΚ
IΘΚ JΘΚ
JΘΚ
ΓΨΫβΈωΓΩ
BΈΣ![]() Θ§AΚΆCl2‘ΎΙβ’’ΧθΦΰœ¬ΖΔ…ζΆιΜυ…œΒΡ»Γ¥ζΖ¥”Π…ζ≥…BΘ§‘ρAΈΣ
Θ§AΚΆCl2‘ΎΙβ’’ΧθΦΰœ¬ΖΔ…ζΆιΜυ…œΒΡ»Γ¥ζΖ¥”Π…ζ≥…BΘ§‘ρAΈΣ![]() Θ§BΖΔ…ζ“―÷ΣiΒΡΖ¥”Π…ζ≥…ΒΡCΈΣ
Θ§BΖΔ…ζ“―÷ΣiΒΡΖ¥”Π…ζ≥…ΒΡCΈΣ![]() Θ§CΚΆH2‘Ύ¥ΏΜ·ΦΝΦ”»»ΧθΦΰœ¬Φ”«βΜΙ‘≠…ζ≥…ΒΡDΈΣ
Θ§CΚΆH2‘Ύ¥ΏΜ·ΦΝΦ”»»ΧθΦΰœ¬Φ”«βΜΙ‘≠…ζ≥…ΒΡDΈΣ![]() Θ§DΚΆ
Θ§DΚΆ![]() ΖΔ…ζ“―÷ΣiiΒΡΖ¥”Π…ζ≥…EΈΣ
ΖΔ…ζ“―÷ΣiiΒΡΖ¥”Π…ζ≥…EΈΣ![]() Θ§E‘Ύ“ΜΕ®ΧθΦΰœ¬ΚΆ
Θ§E‘Ύ“ΜΕ®ΧθΦΰœ¬ΚΆ![]() Ζ¥”Π…ζ≥…FΘ§FΚΆ ‘ΦΝa‘ΎNaOHΧθΦΰœ¬ΖΔ…ζ»Γ¥ζΖ¥”Π…ζ≥…GΘ§Ε‘±»GΚΆFΒΡΫαΙΙΩ…÷Σ ‘ΦΝaΈΣ
Ζ¥”Π…ζ≥…FΘ§FΚΆ ‘ΦΝa‘ΎNaOHΧθΦΰœ¬ΖΔ…ζ»Γ¥ζΖ¥”Π…ζ≥…GΘ§Ε‘±»GΚΆFΒΡΫαΙΙΩ…÷Σ ‘ΦΝaΈΣ![]() Θ§GΨ≠»ΐ≤ΫΖ¥”ΠΒΟΒΫFΘ§Ψί¥ΥΫβ¥πΓΘ
Θ§GΨ≠»ΐ≤ΫΖ¥”ΠΒΟΒΫFΘ§Ψί¥ΥΫβ¥πΓΘ
(1)ΗυΨί“‘…œΖ÷ΈωΘ§AΈΣ![]() Θ§ΤδΟϊ≥Τ «ΦΉ±ΫΘ§
Θ§ΤδΟϊ≥Τ «ΦΉ±ΫΘ§
Ι ¥πΑΗΈΣΘΚΦΉ±ΫΘΜ
(2) BΖΔ…ζ“―÷ΣiΒΡΖ¥”Π…ζ≥…ΒΡCΈΣ![]() Θ§¬»‘≠Ή”±Μ-CN»Γ¥ζΘ§Ζ¥”Πάύ–Ά «»Γ¥ζΖ¥”ΠΘ§
Θ§¬»‘≠Ή”±Μ-CN»Γ¥ζΘ§Ζ¥”Πάύ–Ά «»Γ¥ζΖ¥”ΠΘ§
Ι ¥πΑΗΈΣΘΚ»Γ¥ζΖ¥”ΠΘΜ
(3)BΈΣ![]() Θ§ΤδΆ§Ζ÷“λΙΙΧεΘ§Κ§±ΫΜΖ«“ΚΥ¥≈Ι≤’ώ«βΤΉ÷–≥ωœ÷»ΐΉιΖεΘ§ΥΒΟςΦΉΜυΚΆ¬»‘≠Ή”‘Ύ±ΫΜΖ…œ«“¥Π”ΎΕ‘ΈΜΘ§ΤδΫαΙΙΦρ ΫΈΣ
Θ§ΤδΆ§Ζ÷“λΙΙΧεΘ§Κ§±ΫΜΖ«“ΚΥ¥≈Ι≤’ώ«βΤΉ÷–≥ωœ÷»ΐΉιΖεΘ§ΥΒΟςΦΉΜυΚΆ¬»‘≠Ή”‘Ύ±ΫΜΖ…œ«“¥Π”ΎΕ‘ΈΜΘ§ΤδΫαΙΙΦρ ΫΈΣ![]() Θ§
Θ§
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
(4) CΚΆH2‘Ύ¥ΏΜ·ΦΝΦ”»»ΧθΦΰœ¬Φ”«βΜΙ‘≠…ζ≥…ΒΡDΈΣ![]() Θ§-C
Θ§-C![]() NΉΣΜ·ΈΣ-CH2-NH2Θ§Υυ“‘1 mol Cάμ¬έ…œ–η“ΣœϊΚΡ2mol H2…ζ≥…DΓΘ
NΉΣΜ·ΈΣ-CH2-NH2Θ§Υυ“‘1 mol Cάμ¬έ…œ–η“ΣœϊΚΡ2mol H2…ζ≥…DΓΘ
Ι ¥πΑΗΈΣΘΚ2ΘΜ
(5) DΚΆ![]() ΖΔ…ζ“―÷ΣiiΒΡΖ¥”Π…ζ≥…ΒΡEΈΣ
ΖΔ…ζ“―÷ΣiiΒΡΖ¥”Π…ζ≥…ΒΡEΈΣ![]() Θ§Μ·―ßΖΫ≥Χ ΫΈΣ
Θ§Μ·―ßΖΫ≥Χ ΫΈΣ Θ§
Θ§
Ι ¥πΑΗΈΣΘΚ ΘΜ
ΘΜ
(6)”…FΒΡΫαΙΙ![]() Ω…÷ΣΘ§Κ§―θΙΌΡήΆ≈ «
Ω…÷ΣΘ§Κ§―θΙΌΡήΆ≈ « ΚΆτ«ΜυΘ®Μρ-OHΘ©Θ§
ΚΆτ«ΜυΘ®Μρ-OHΘ©Θ§
Ι ¥πΑΗΈΣΘΚτ«ΜυΘ®Μρ-OHΘ©ΘΜ
(7) FΚΆ ‘ΦΝa‘ΎNaOHΧθΦΰœ¬ΖΔ…ζ»Γ¥ζΖ¥”Π…ζ≥…GΘ§Ε‘±»GΚΆFΒΡΫαΙΙΩ…÷Σ ‘ΦΝaΈΣ![]() Θ§
Θ§
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
(8)GΈΣ Θ§GΚΆCu/O2Θ§Φ”»» ±ΖΔ…ζ¥ΏΜ·―θΜ·…ζ≥…IΈΣ
Θ§GΚΆCu/O2Θ§Φ”»» ±ΖΔ…ζ¥ΏΜ·―θΜ·…ζ≥…IΈΣ Θ§IΖΔ…ζ»©Μυ…œΒΡΦ”≥…Ζ¥”Π…ζ≥…JΈΣ
Θ§IΖΔ…ζ»©Μυ…œΒΡΦ”≥…Ζ¥”Π…ζ≥…JΈΣ Θ§J≥…ΜΖΆ―Υ°…ζ≥…HΈΣ
Θ§J≥…ΜΖΆ―Υ°…ζ≥…HΈΣ Θ§
Θ§
Ι ¥πΑΗΈΣΘΚIΘΚ ΘΜJΘΚ
ΘΜJΘΚ ΓΘ
ΓΘ


 ΖΔ…ΔΥΦΈ§–¬ΩΈΧΟœΒΝ–¥πΑΗ
ΖΔ…ΔΥΦΈ§–¬ΩΈΧΟœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩO3“≤ «“Μ÷÷ΚήΚΟΒΡœϊΕΨΦΝΘ§ΨΏ”–ΗΏ–ßΓΔΫύΨΜΓΔΖΫ±ψΓΔΨ≠ΦΟΒ»”≈ΒψΓΘO3Ω…»ή”ΎΥ°Θ§‘ΎΥ°÷–“ΉΖ÷ΫβΘ§≤ζ…ζΒΡ[O]ΈΣ”Έάκ―θ‘≠Ή”Θ§”–Κή«ΩΒΡ…±ΨζœϊΕΨΡήΝΠΓΘ≥ΘΈ¬≥Θ―Ιœ¬ΖΔ…ζΖ¥”Π»γœ¬ΘΚ
Ζ¥”ΠΔΌΘΚO3![]() O2ΘΪ[O] ΠΛHΘΨ0 ΤΫΚβ≥Θ ΐΈΣK1ΘΜ
O2ΘΪ[O] ΠΛHΘΨ0 ΤΫΚβ≥Θ ΐΈΣK1ΘΜ
Ζ¥”ΠΔΎΘΚ [O]ΘΪO3![]() 2O2 ΠΛHΘΦ0 ΤΫΚβ≥Θ ΐΈΣK2ΘΜ
2O2 ΠΛHΘΦ0 ΤΫΚβ≥Θ ΐΈΣK2ΘΜ
ΉήΖ¥”ΠΘΚ 2O3![]() 3O2 ΠΛHΘΦ0 ΤΫΚβ≥Θ ΐΈΣKΓΘ
3O2 ΠΛHΘΦ0 ΤΫΚβ≥Θ ΐΈΣKΓΘ
œ¬Ν––π ω’ΐ»ΖΒΡ «( )
A. ΫΒΒΆΈ¬Ε»Θ§KΦθ–Γ B. KΘΫK1ΘΪK2
C. Β±…ΐΈ¬Θ§Ω…ΧαΗΏœϊΕΨ–ß¬ D. ―Ι«Ω‘ω¥σΘ§K2Φθ–Γ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫπ τ“±ΝΕΚΆ¥Πάμ≥Θ…φΦΑ―θΜ·ΜΙ‘≠Ζ¥”ΠΓΘ
Θ®1Θ©”…œ¬Ν–Έο÷ “±ΝΕœύ”ΠΫπ τ ±≤…”ΟΒγΫβΖ®ΒΡ « Θ§
aΘ°Fe2O3 bΘ°NaCl cΘ°Cu2S dΘ°Al2O3
Θ®2Θ©Μ‘Ά≠ΩσΘ®Cu2SΘ©Ω…ΖΔ…ζΖ¥”Π2Cu2S+2H2SO4+5O2==4CuSO4+2H2OΘ§ΗΟΖ¥”ΠΒΡΜΙ‘≠ΦΝ « Θ§Β±1mol O2ΖΔ…ζΖ¥”Π ±Θ§ΜΙ‘≠ΦΝΥυ ßΒγΉ”ΒΡΈο÷ ΒΡΝΩΈΣ molΓΘœρCuSO4»ή“Κ÷–Φ”»κΟΨΧθ ±”–ΤχΧε…ζ≥…Θ§ΗΟΤχΧε « ΓΘ
Θ®3Θ©œ¬ΆΦΈΣΒγΫβΨΪΝΕ“χΒΡ Ψ“βΆΦΘ§ Θ®ΧνΓΑaΓ±ΜρΓΑbΓ±Θ©ΦΪΈΣΚ§”–‘”÷ ΒΡ¥÷“χΘ§»τbΦΪ ”–…ΌΝΩΚλΉΊ…ΪΤχΧε≤ζ…ζΘ§‘ρ…ζ≥…ΗΟΤχΧεΒΡΒγΦΪΖ¥”Π ΫΈΣ Θ§

Θ®4Θ©ΈΣ¥Πάμ“χΤς±μΟφΒΡΚΎΑΏΘ®Ag2SΘ©Θ§ΫΪ“χΤς÷Ο”Ύ¬Ν÷Τ»ίΤςάοΒΡ ≥―ΈΥ°÷–≤Δ”κ¬ΝΫ”¥ΞΘ§Ag2SΉΣΜ·ΈΣAgΘ§ ≥―ΈΥ°ΒΡΉς”ΟΈΣ ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNAΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ ΐ÷ΒΓΘœ¬Ν–”–ΙΊ–π ω’ΐ»ΖΒΡ «
A.16g”…O2ΚΆO3Ήι≥…ΒΡΜλΚœΤχΧε÷–ΒΡ―θ‘≠Ή” ΐΈΣ2NA
B.1molN2”κΉψΝΩH2≥δΖ÷Ζ¥”Π…ζ≥…NH3ΒΡΖ÷Ή” ΐΈΣ2NA
C.1mol Fe»ή”ΎΙΐΝΩœΓœθΥαΘ§ΉΣ“ΤΒΡΒγΉ” ΐΈΣ3NA
D.±ξΉΦΉ¥Ωωœ¬Θ§2.24L±Ϋ÷–Κ§”–ΒΡ‘≠Ή” ΐΈΣ1.2NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≈δ÷Τ400 mL 0.5 molΓΛLΘ≠1ΒΡNaOH»ή“ΚΘ§ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΦΤΥψΘΚ–η“ΣNaOHΙΧΧεΒΡ÷ ΝΩΈΣ______ΓΘ
Θ®2Θ©Ρ≥―ß…ζ”ΟΆ–≈ΧΧλΤΫ≥ΤΝΩ“ΜΗω–Γ…’±≠ΒΡ÷ ΝΩΘ§≥ΤΝΩ«ΑΑ―”Έ¬κΖ≈‘Ύ±ξ≥ΏΒΡΝψΩΧΕ»¥ΠΘ§ΧλΤΫΨ≤÷Ι ±ΖΔœ÷ ÷Η’κ‘ΎΖ÷Ε»≈ΧΒΡΤΪ”“ΈΜ÷ΟΘ§¥Υ ±Ήσ±ΏΒΡΆ–≈ΧΫΪ______(ΧνΓΑΗΏ”ΎΓ±ΜρΓΑΒΆ”ΎΓ±)”“±ΏΒΡΆ–≈ΧΓΘ”ϊ ΙΧλΤΫΤΫΚβΘ§ΥυΫχ––ΒΡ≤ΌΉςΈΣ_______ΓΘΦΌΕ®Ήν÷’≥ΤΒΟ–Γ…’±≠ΒΡ÷ ΝΩΈΣ______(ΧνΓΑ32.6 gΓ±ΜρΓΑ31.61 gΓ±)Θ§
Θ®3Θ©≈δ÷ΤΖΫΖ®ΘΚ…ηΦΤΈεΗω≤ΌΉς≤Ϋ÷ηΘΚ
ΔΌ œρ Δ”–NaOHΒΡ…’±≠÷–Φ”»κ200 mL’τΝσΥ° ΙΤδ»ήΫβΘ§≤Δά以÷Ν “Έ¬ΘΜ
ΔΎ ΦΧ–χΆυ»ίΝΩΤΩ÷–Φ”’τΝσΥ°÷Ν“ΚΟφΫ”ΫϋΩΧΕ»œΏ1ΓΪ2 cm¥ΠΘΜ
Δέ ΫΪNaOH»ή“Κ―Ί≤ΘΝßΑτΉΔ»κ500 mL»ίΝΩΤΩ÷–ΘΜ
Δή ‘Ύ…’±≠÷–Φ”»κ…ΌΝΩΒΡ’τΝσΥ°Θ§–Γ–Ρœ¥Β”2ΓΪ3¥ΈΚσ“Τ»κ»ίΝΩΤΩΘΜ
Δί ΗΡ”ΟΫΚΆΖΒΈΙήΦ”’τΝσΥ°÷ΝΩΧΕ»œΏΘ§Φ”Η«“Γ‘»ΓΘ
‘ΫΪ“‘…œ≤ΌΉς≈≈≥ωœ»ΚσΥ≥–ρ______ΓΘ
Θ®4Θ©Ρ≥―ß…ζ ΒΦ ≈δ÷ΤNaOH»ή“ΚΒΡ≈®Ε»ΈΣ0.48 molΓΛLΘ≠1Θ§‘≠“ρΩ…Ρή «______ΓΘ
AΘ° Ι”Ο¬Υ÷Ϋ≥ΤΝΩ«β―θΜ·ΡΤΙΧΧε |
BΘ°»ίΝΩΤΩ÷–‘≠ά¥¥φ”–…ΌΝΩ’τΝσΥ° |
CΘ°»ήΫβNaOHΒΡ…’±≠Έ¥Ψ≠Εύ¥Έœ¥Β” |
DΘ°ΫΚΆΖΒΈΙήΦ”Υ°ΚσΕ®»ί ±―ω ”ΩΧΕ» |
Θ®5Θ©‘Ύœ¬Ν–≈δ÷Τ0.5 molΓΛLΘ≠1NaOH»ή“ΚΙΐ≥Χ Ψ“βΆΦ÷–”–¥μΈσΒΡ «(Χν–ρΚ≈)______ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≤πΩΣ1 mol Ι≤ΦέΦϋΥυΈϋ ’ΒΡΡήΝΩΜρ–Έ≥…1 mol Ι≤ΦέΦϋΥυ ΆΖ≈ΒΡΡήΝΩ≥ΤΈΣΦϋΡήΓΘ“―÷ΣΘΚHΘ≠HΦϋΡήΈΣ436 kJ /molΘ§HΘ≠NΦϋΡήΈΣ391 kJ /molΘ§ N2 (g)+ 3H2(g) ![]() 2NH3(g) ΓςHΘΫΘ≠92.4 kJ /molΘ§œ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «(ΓΓΓΓ)
2NH3(g) ΓςHΘΫΘ≠92.4 kJ /molΘ§œ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «(ΓΓΓΓ)
A. HΘ≠H±»NΓ‘NΗϋάΈΙΧ
B. NΓ‘NΦϋΡή‘ΦΈΣ946 kJ/mol
C. Κœ≥…Α±Ζ¥”Π―Γ‘ώ Β±ΒΡ¥ΏΜ·ΦΝ «ΈΣΝΥΧαΗΏH2ΒΡΉΣΜ·¬
D. 0.5 mol N2ΚΆ1.5 mol H2‘ΎΧβΗχΧθΦΰœ¬≥δΖ÷Ζ¥”ΠΘ§Ζ≈≥ω»»ΝΩΈΣ46.2 kJ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Έ¬Ε»œ¬2 LΟή±’»ίΤς÷–Θ§3÷÷ΤχΧεΤπ ΦΉ¥Χ§ΚΆΤΫΚβΉ¥Χ§ ±ΒΡΈο÷ ΒΡΝΩ(n)»γœ¬±μΥυ ΨΓΘ
X | Y | W | |
n(Τπ ΦΉ¥Χ§)/mol | 2 | 1 | 0 |
n(ΤΫΚβΉ¥Χ§)/mol | 1 | 0.5 | 1.5 |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «(ΓΓΓΓ)
A. …ΐΗΏΈ¬Ε»Θ§»τWΒΡΧεΜΐΖ÷ ΐΦθ–ΓΘ§‘ρ¥ΥΖ¥”ΠΠΛH>0
B. ΗΟΈ¬Ε»œ¬Θ§¥ΥΖ¥”ΠΒΡΤΫΚβ≥Θ ΐKΘΫ6.75
C. ‘ω¥σ―Ι«ΩΘ§’ΐΓΔΡφΖ¥”ΠΥΌ¬ Ψυ‘ω¥σΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·
D. ΗΟΈ¬Ε»œ¬Θ§‘ΌœρΗΟ»ίΤς÷–Φ”»κ1.5 mol WΘ§¥οΒΫ–¬ΤΫΚβ ±Θ§c(X)ΘΫ0.25 molΓΛLΘ≠1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ(1)±ξΉΦΉ¥Ωωœ¬Θ§32gCH4ΚΆ22.4LCO2ΒΡΟήΕ»÷°±»ΈΣ_______ΘΜΈο÷ ΒΡΝΩ÷°±»ΈΣ______ΓΘ
(2)ΫΪ20gNaOH»ή”ΎΥ°ΒΟ2L»ή“ΚΘ§‘ρΗΟNaOH»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ_________ΘΜ»τ¥”÷–»Γ≥ω100mLNaOH»ή“ΚΘ§Τδ÷–Κ§”–ΒΡNa+”κ____molNa2CO3Κ§”–ΒΡNa+ ΐΡΩœύΆ§ΓΘ
(3)“―÷Σ±ξΉΦΉ¥Ωωœ¬Θ§œ÷”–ΥΡ÷÷Έο÷ ΘΚ
A.49g H2SO4 B.6.02ΓΝ1023ΗωH2O C.44.8L COΚΆCO2ΜλΚœΤχΧε D.6g H2
Τδ÷–ΥυΚ§Ζ÷Ή”Έο÷ ΒΡΝΩΉν–ΓΒΡ «____________Θ®ΧνΉ÷ΡΗΘ©ΘΜΥυ’ΦΧεΜΐΉν¥σΒΡ «________Θ®ΧνΉ÷ΡΗΘ©ΘΜ»τC÷–ΤχΧε÷ΊΝΩΈΣ64gΘ§‘ρΗΟΜλΚœΤχΧε÷–COΚΆCO2ΒΡΧεΜΐ±»ΈΣ__________________ΓΘ
(4)±ξΉΦΉ¥Ωωœ¬Θ§ΫΪaLHClΆξ»Ϊ»ή”Ύ100mLΥ°Θ§ΦΌ…ηΗΟ»ή“ΚΒΡΟήΕ»ΈΣΠ― gΓΛmLΘ≠1Θ§‘ρΥυΒΟ―ΈΥα»ή“Κ÷–»ή÷ ΒΡΈο÷ ΒΡΝΩΈΣ________________Θ§»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ__________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬ΆΦ±μ Ψ…χΆΗΉς”ΟΉΑ÷ΟΆΦΘ§Τδ÷–ΑκΆΗΡΛΈΣΑρκΉΡΛΘ§ΦΉΓΔ±ϊΉΑ÷Ο÷–AΓΔBΓΔaΓΔb»ή“Κ≈®Ε»Ζ÷±π”ΟMAΓΔMBΓΔMaΓΔMb±μ ΨΘ§““ΓΔΕΓΉΑ÷ΟΖ÷±π±μ Ψ“ΜΕΈ ±ΦδΚσΦΉΓΔ±ϊΉΑ÷ΟΒΡΉ¥Χ§Θ§“ΚΟφ…œ…ΐΒΡΗΏΕ»Ζ÷±πΈΣh1ΓΔh2ΓΘ»γΙϊAΓΔBΓΔaΓΔbΨυΈΣ’αΧ«»ή“ΚΘ§«“MA>MBΘ§MaΘΫMb>MAΘ§‘ρ¥οΒΫΤΫΚβΚσ(ΓΓΓΓ)
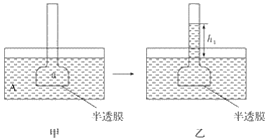
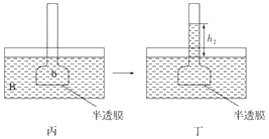
A. h1>h2ΓΔMa>MbB. h1>h2ΓΔMa<Mb
C. h1<h2ΓΔMa<MbD. h1<h2ΓΔMa>Mb
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com