
| A、增大压强,使活化分子数目增加,化学反应速率一定增大 |
| B、活化分子间所发生的分子间碰撞均为有效碰撞 |
| C、升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| D、加入反应物,使活化分子百分数增加,化学反应速率一定增大 |


科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验设计 |
| A | 证明SO2有漂白性 | 把SO2通入品红溶液中 |
| B | 除去Cu粉中的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入KSCN溶液,再滴加氯水 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
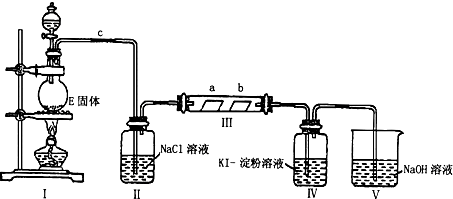
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
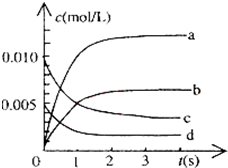
| n(NO2) |
| n(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸和氢氧化钠溶液之间的中和反应 | ||||
B、CO2+C
| ||||
C、金属镁燃烧:2Mg+O2
| ||||
| D、生石灰溶于水:CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
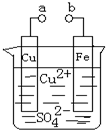
| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:Cu2++2e-=Cu |
| C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D、a和b分别连接直流电源正、负极,溶液中的Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| B、在101KPa下氢气的标准燃烧热△H=-285.5 kJ?mol-1,则水分解的热化学方程式 2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| C、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的标准燃烧热为110.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78gNa2O2固体中含有的阴离子数为NA |
| B、标准状况下,2.24L氖气所含原子数为0.2NA |
| C、1molCl2与足量Fe反应,转移的电子数为3NA |
| D、标准状况下,2.24L已烷含有碳原子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com