
【题目】无水三氯化铬![]() 在工业上主要用作媒染剂和催化剂。某化学小组在氮气的氛围下用
在工业上主要用作媒染剂和催化剂。某化学小组在氮气的氛围下用![]() 和
和![]() 在高温下制备无水三氯化铬,并测定所制得产品中三氯化铬的质量分数。
在高温下制备无水三氯化铬,并测定所制得产品中三氯化铬的质量分数。
实验原理: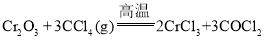
已知:①![]() 熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
②![]() 沸点为57.6℃;
沸点为57.6℃;
③在碱性条件下,![]() 能把
能把![]() 氧化为
氧化为![]() ;
;
在酸性条件下,![]() 能把
能把![]() 还原为
还原为![]() 。
。
回答下列问题:
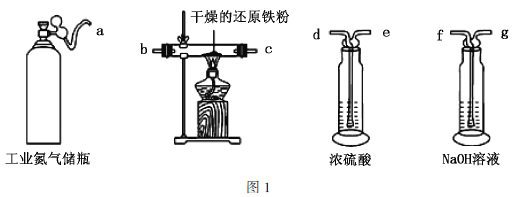
Ⅰ.氮气的制备
(1)利用工业氮气(混有![]() 、
、![]() 、
、![]() )制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→________。
)制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→________。
Ⅱ.无水三氯化铬的制备
实验装置如图2所示(加热、夹持等装置已略去)。
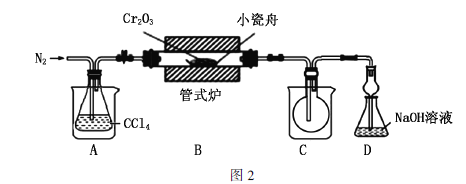
(2)通入![]() 的作用是_____________(写出2点)。
的作用是_____________(写出2点)。
(3)装置A和装置C的烧杯中分别盛放________、________。
(4)制备![]() 时生成的气体
时生成的气体![]() (俗称光气)有毒,
(俗称光气)有毒,![]() 遇水发生水解,反应方程式为
遇水发生水解,反应方程式为![]() 。为了防止污染环境,用足量的NaOH溶液吸收光气,其化学方程式为________________。
。为了防止污染环境,用足量的NaOH溶液吸收光气,其化学方程式为________________。
(5)图2装置中有设计不合理的地方,你认为应该改进的措施有______________。
Ⅲ.产品中![]() 质量分数的测定
质量分数的测定
a.称取![]()
![]() 产品,在强碱性条件下,加入过量的30%
产品,在强碱性条件下,加入过量的30%![]() 溶液,小火加热使
溶液,小火加热使![]() 完全转化为
完全转化为![]() ,继续加热一段时间;
,继续加热一段时间;
b.冷却后加适量的蒸馏水,再滴入适量的浓![]() 和浓
和浓![]() ,使
,使![]() 转化为
转化为![]() ;
;
c.用新配制的![]() 硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:
硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:![]() ),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
回答下列问题:
(6)①上述操作a中“继续加热一段时间”的目的是________。
②加浓![]() 的目的是为了防止指示剂提前变色。若不加浓
的目的是为了防止指示剂提前变色。若不加浓![]() ,则测得的
,则测得的![]() 的质量分数将________(填“偏低”、“偏高”或“不变”)。
的质量分数将________(填“偏低”、“偏高”或“不变”)。
③产品中![]() 的质量分数为________%(保留一位小数)。
的质量分数为________%(保留一位小数)。
【答案】![]() 排出空气、吹出
排出空气、吹出![]() 蒸气、吹出
蒸气、吹出![]() 及尾气热水 热水 冷水
及尾气热水 热水 冷水 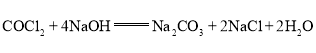 装置B与C之间的导管可能因
装置B与C之间的导管可能因![]() 凝华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管) 加热使过量
凝华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管) 加热使过量![]() 完全分解,以免在酸性条件下,
完全分解,以免在酸性条件下,![]() 能把
能把![]() 还原为
还原为![]() 偏低 95.1%
偏低 95.1%
【解析】
利用工业氮气(混有![]() 、
、![]() 、
、![]() )制取纯净干燥的氮气,气体的除杂顺序为
)制取纯净干燥的氮气,气体的除杂顺序为![]() 、
、![]() 、
、![]() ,反应前通入氮气是为了排尽装置内的空气,反应中通入氮气,是为了将
,反应前通入氮气是为了排尽装置内的空气,反应中通入氮气,是为了将![]() 蒸出,反应后通入氮气,将残留尾气吹出进行处理,利用氧化还原反应计算质量分数。
蒸出,反应后通入氮气,将残留尾气吹出进行处理,利用氧化还原反应计算质量分数。
⑴利用工业氮气(混有![]() 、
、![]() 、
、![]() )制取纯净干燥的氮气,气体的除杂顺序为
)制取纯净干燥的氮气,气体的除杂顺序为![]() 、
、![]() 、
、![]() ,因此通入顺序
,因此通入顺序![]() ;故答案为:
;故答案为:![]() 。
。
⑵反应前通入氮气是为了排尽装置内的空气,以免![]() 被氧气氧化;反应中通入氮气,是为了将
被氧气氧化;反应中通入氮气,是为了将![]() 蒸气进入硬质玻璃管中参加反应;反应后通入氮气,是为了将硬质玻璃管中的产物吹出以提高产率,并将残留尾气吹出进行处理,避免污染空气;故答案为:排出空气、吹出
蒸气进入硬质玻璃管中参加反应;反应后通入氮气,是为了将硬质玻璃管中的产物吹出以提高产率,并将残留尾气吹出进行处理,避免污染空气;故答案为:排出空气、吹出![]() 蒸气、吹出
蒸气、吹出![]() 及尾气热水。
及尾气热水。
⑶装置A的烧杯中盛放热水使![]() 汽化,装置C的烧杯中盛放冷水使生成的
汽化,装置C的烧杯中盛放冷水使生成的![]() 凝华为固体;故答案为:热水;冷水。
凝华为固体;故答案为:热水;冷水。
⑷可看成光气的水解产物![]() 和HCl分别与足量NaOH反应生成
和HCl分别与足量NaOH反应生成![]() 和NaCl,因此化学方程式为
和NaCl,因此化学方程式为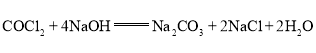 ;故答案为:
;故答案为: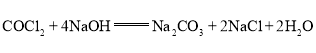 。
。
⑸装置B与装置C之间的导管可能因![]() 凝华而发生堵塞,应该换为较粗的导管。为了防止三氯化铬潮解,在装置C和D之间连接一个盛有碱石灰的干燥管(或U形管);故答案为:装置B与C之间的导管可能因
凝华而发生堵塞,应该换为较粗的导管。为了防止三氯化铬潮解,在装置C和D之间连接一个盛有碱石灰的干燥管(或U形管);故答案为:装置B与C之间的导管可能因![]() 华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管)。
华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管)。
⑹①加热使过量![]() 完全分解,以免在酸性条件下,
完全分解,以免在酸性条件下,![]() 把
把![]() 还原为
还原为![]() ;故答案为:加热使过量
;故答案为:加热使过量![]() 完全分解,以免在酸性条件下,
完全分解,以免在酸性条件下,![]() 能把
能把![]() 还原为
还原为![]() 。
。
②若指示剂提前变色,消耗的标准液体积将偏小,则测得的![]() 含量偏低;故答案为:偏低。
含量偏低;故答案为:偏低。
③由离子方程式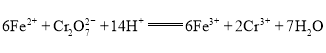 可知
可知
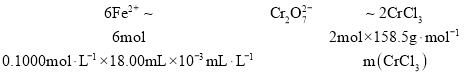
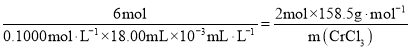 ,
,![]() ,故该实验中
,故该实验中![]() 的质量分数为
的质量分数为![]() ;故答案为:95.1%。
;故答案为:95.1%。


科目:高中化学 来源: 题型:
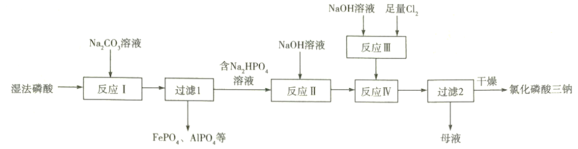
【题目】氯化磷酸三钠![]() 具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
已知:a.温度高时,NaClO易分解。
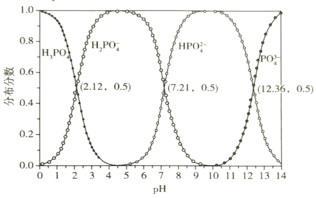
b.常温下,磷酸的物种分布分数与pH的关系如下图所示:
回答下列问题:
(1)硫酸分解Ca5(PO4)3F时产生的有毒气体主要是________________(填化学式)。
(2)反应Ⅰ中磷酸转化为钠盐,其钠盐再与Fe3+、Al3+作用形成沉淀。
①反应Ⅰ中发生多个反应,其中磷酸转化为Na2HPO4的主要离子方程式为___________,常温下应控制pH约为_____________________________。
②常温下,HPO![]() +Fe3+
+Fe3+![]() FePO4+H+的lgK为_________
FePO4+H+的lgK为_________![]() 。
。
(3)反应Ⅱ中不用Na2CO3溶液的原因是____________________________________________;
(4)反应Ⅲ的化学方程式为____________________________________________;
反应Ⅳ中两种溶液混合后需快速冷却,其目的是____________________________;
“母液”中的溶质有NaClO、_____________________(填2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(1)H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1(Q1、Q2、Q3均大于0)若要使1mol液态甲醇完全燃烧,最后恢复到室温,其△H为
A.Q2- 0.5Q3-2Q1B.0.5Q3-Q2+2Q1C.Q3-2Q2+4Q1D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活社会发展息息相关。下列说法错误的是( )
A.![]() 的乙醇和84消毒液的消毒原理不相同
的乙醇和84消毒液的消毒原理不相同
B.制造N95口罩的聚丙烯树脂属于无机非金属材料
C.玛瑙的主要成分是二氧化硅,陶瓷的主要成分是硅酸盐
D.海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(1)通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为__________________ 、______________________,制得等量H2所需能量较少的是___________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_____ %,反应平衡常数K =___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2 _____________a1,该反应的H __________0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 _____ (填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物9,10-二甲基菲的结构如图所示,下列关于该物质的说法正确的是

A. 该物质分子式为C16H12
B. 该物质与甲苯互为同系物
C. 该物质能与溴水发生取代反应和加成反应
D. 该物质苯环上七氯代物的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com