
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径,由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ/mol
CH3OH(g) △H3=-90.77kJ/mol
回答下列问题:
(1)反应Ⅱ的△H2=______ ,反应 I自发进行条件是 ______(填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下3 L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。
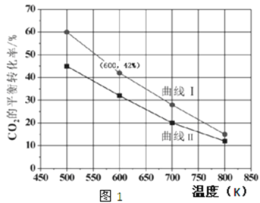
①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3 mol,n(CO2)=1.5 mol B:n(H2)=3 mol,n(CO2)=2 mol,
曲线 I代表哪种投入方式______(用A、B表示)。
②在温度为500K的条件下,按照A方式充入3 molH2和1.5 molCO2,该反应10 min时达到平衡:
a.此温度下的平衡常数为______;500K时,若在此容器中开始充入0.3 mol H2和0.9 molCO2、0.6 mol CH3OH、x mol H2O,若使反应在开始时正向进行,则x应满足的条件是 ______。
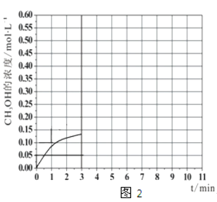
b.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3 min时,迅速将体系温度升至600 K,请在图2中画出3~10 min内容器中CH3OH浓度的变化趋势曲线__________。
(3)化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应,图3是甲醇燃料电池的模型。
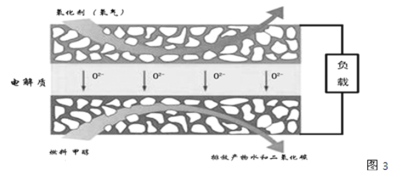
①写出该燃料电池的负极反应式 ______。
②如果用该电池作为电解装置,当有16 g甲醇发生反应时,则理论上提供的电量最多为 ______(法拉第常数为9.65×104C/mol)
【答案】+41.19 kJ/mol 较低温 A 450 0<x<2.025  CH3OH-6e-+3O2-=CO2↑+2H2O 2.895×105 C
CH3OH-6e-+3O2-=CO2↑+2H2O 2.895×105 C
【解析】
(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应自发进行的判断依据是△G=△H-T△S<0;
(2)①图象分析相同温度下,两种反应物,增大一种物质的量会提高另一种物质的转化率;
②a.根据物质反应的转换关系计算;
b.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲醇失电子发生氧化反应,结合导电离子和电荷守恒分析书写;
②依据电极反应计算转移电子数,结合法拉第常数为9.65×104C/mol计算电量。
(1)反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1=-49.58kJ/mol
CH3OH(g)+H2O(g)△H1=-49.58kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2
CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ/mol
CH3OH(g) △H3=-90.77kJ/mol
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58 kJ/mol)-(-90.77kJ/mol)=+41.19 kJ/mol;根据反应自发行的判据:△G=△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行;
(2)①A:n(H2)=3 mol,n(CO2)=1.5 mol,B:n(H2)=3 mol,n(CO2)=2 mol,二者比较,B相当于增大二氧化碳的量,平衡正向移动,但CO2的转化率反而降低,转化率小于A,所以曲线该I代表A的投料;
②在温度为500K的条件下,在3 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,该反应10 min时达到平衡,二氧化碳的转化率是60%,则转化的CO2物质的量浓度为△c(CO2)= ![]() ×60%=0.3 mol/L,根据反应方程式CO2(g)+3H2(g)
×60%=0.3 mol/L,根据反应方程式CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中物质反应关系可知,△c(H2)= 3△c(CO2)=0.9 mol/L,△c(CH3OH)=△c(H2O)=△n(CO2)=0.3mol/L,所以各种物质的平衡浓度:c(CO2)=(0.5-0.3) mol/L=0.2 mol/L,c(H2)=(1-0.9)mol/L=0.1mol/L;c(CH3OH)=c(H2O)=0.3 mol/L,所以
CH3OH(g)+H2O(g)中物质反应关系可知,△c(H2)= 3△c(CO2)=0.9 mol/L,△c(CH3OH)=△c(H2O)=△n(CO2)=0.3mol/L,所以各种物质的平衡浓度:c(CO2)=(0.5-0.3) mol/L=0.2 mol/L,c(H2)=(1-0.9)mol/L=0.1mol/L;c(CH3OH)=c(H2O)=0.3 mol/L,所以
a.该温度下,反应I的平衡常数K=![]() =450,500K时,若在此容器中开始充入0.3molH2和0.9 mol CO2、0.6 mol CH3OH、x mol H2O,浓度分别为0.1 mol/L,0.3 mol/L,0.2 mol/L,
=450,500K时,若在此容器中开始充入0.3molH2和0.9 mol CO2、0.6 mol CH3OH、x mol H2O,浓度分别为0.1 mol/L,0.3 mol/L,0.2 mol/L,![]() mol/L,若使反应在开始时正向进行,浓度商Qc=
mol/L,若使反应在开始时正向进行,浓度商Qc= <K=450,x=2.025,所以x应满足的条件是0<x<2.025;
<K=450,x=2.025,所以x应满足的条件是0<x<2.025;
b.当反应时间达到3min时,迅速将体系温度升至600K,反应正向进行,反应速率加快,反应产生更多的甲醇,甲醇的浓度会增加,图象为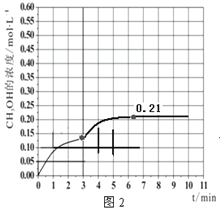 。
。
(3)①以固体氧化锆氧化钇为电解质这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲醇失去电子,发生氧化反应,结合导电离子和电荷守恒分析书写电极反应为:CH3OH-6e-+3O2-=CO2↑+2H2O;
②16g甲醇物质的量n(CH3OH)= ![]() =0.5 mol,则其发生反应时转移电子的物质的量n(e-)=0.5 mol×6=3 mol,因此理论上提供的电量最多Q=3 mol×9.65×104 C/mol=2.895×105 C。
=0.5 mol,则其发生反应时转移电子的物质的量n(e-)=0.5 mol×6=3 mol,因此理论上提供的电量最多Q=3 mol×9.65×104 C/mol=2.895×105 C。


科目:高中化学 来源: 题型:
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:

查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO72-。回答下列问题:
(1)滤渣D的化学式为________,溶液A中加入过量H2O2的离子方程式是_____________。
(2)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。
(3)酸化滤液D时,不选用盐酸的原因是_____________。
(4)固体E的主要成分是Na2SO4,根据如图分析操作a为蒸发浓缩、__________、洗涤、干燥。

(5)已知含+6价铬的污水会污染环境,某电镀厂废水中往往含有一定量的Cr2O72-,可用下列方法进行处理。(已知Cr2O72-的浓度为1.0×10-3 mol /L)
方法一:电解法——向废水(酸性)中通入直流电,在阴极上,+6价的铬变为低毒的+3价。
①写出该阴极的电极反应_____________________。
方法二:某研究性学习小组为了变废为宝,在废水中加入绿矾(FeSO4·7H2O)处理得到磁性材料 CrFe2O4(Cr的化合价为+3,Fe的化合价为+3、+2)。
②欲使1 m3该废水中的Cr2O72-完全转化为CrFe2O4 ,理论上需要加入________g绿矾 。(已知FeSO4·7H2O摩尔质量为278g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将A和B各0.32 mol充入10 L的恒容密闭容器中,发生如下反应:A(s)+B(g)![]() 2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.反应前2 min的平均反应速率v(C)=0.004 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前,v(逆)>v(正)
C.其他条件不变,起始时向容器中充入各0.64 mol的A和B,平衡时n(C)<0.48 mol
D.其他条件不变,向平衡体系中再充入0.32 mol B和0.16 mol C,再达到平衡时,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
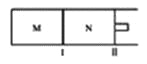
A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
|
容积/L | 1 | 1 | V | |
温度/℃ | T1 | T2 | T1 | |
起始量 | 2 molC(s)、2 mol H2O(g) | 2 mol CO(g)、2 mol H2(g) | 6 molC(s)、 4mol H2O(g) |
下列说法正确的是( )
A.甲容器中,0~5min内的平均反应速率v(CO)=0.1 mol/(L·min)
B.乙容器中,若平衡时n(C)=0.56 mol,则T2>T1
C.温度为T1时,反应的平衡常数为K=9
D.丙容器的容积V=0.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)滤渣的成分为_________________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理:______________。
(2)加入H2O2一段时间后,溶液中有气泡出现并放热,分析产生气泡的原因:____________(用文字表达)。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并____________________。萃取分液的目的是______________(填字母)。
A.除去水溶液中的铁离子
B.增加镁离子在水中的溶解度
C.富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置后,进行操作:______________________________,确定沉淀完全后,再过滤、__________________、__________________,得到MgCO3·3H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
 ,下列说法正确的是( )
,下列说法正确的是( )
A. NaOH溶液可以用氨水来代替
B. 溶液a中含有Al3+、K+、Cl-、Na+、OH-
C. 溶液b中只含有NaCl
D. 向溶液a中滴加盐酸需控制溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10 L,其中可能含有K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )

A.CD段的离子方程式可以表示为:CO32-+CO2+H2O═2HCO3-
B.肯定不存在的离子是SO42-、OH-
C.该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
D.OA段反应的离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为________L(已知:1个e-所带电量为1.6×10-19C)。
Ⅱ.溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为______________。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
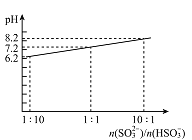
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因________________。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是_____________。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
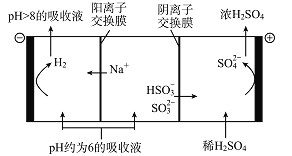
①写出阳极发生的电极反应式________________;
②当电极上有2 mol电子转移时阴极产物的质量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com