
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
|
容积/L | 1 | 1 | V | |
温度/℃ | T1 | T2 | T1 | |
起始量 | 2 molC(s)、2 mol H2O(g) | 2 mol CO(g)、2 mol H2(g) | 6 molC(s)、 4mol H2O(g) |
下列说法正确的是( )
A.甲容器中,0~5min内的平均反应速率v(CO)=0.1 mol/(L·min)
B.乙容器中,若平衡时n(C)=0.56 mol,则T2>T1
C.温度为T1时,反应的平衡常数为K=9
D.丙容器的容积V=0.8 L
【答案】D
【解析】
A. 甲容器中,0~5min内的平均反应速率v(CO)=![]() =0.2 mol/(L·min),A错误;
=0.2 mol/(L·min),A错误;
B. 乙容器中若平衡时n(C)=0.56 mol,根据方程式知,参加反应的n(C)=n(H2O)=n(H2)=n(CO)=0.56 mol,平衡时c(CO)=c(H2)=![]() =1.44mol/L,c(H2O)=0.56 mol÷1 L=0.56 mol,化学平衡常数K乙=
=1.44mol/L,c(H2O)=0.56 mol÷1 L=0.56 mol,化学平衡常数K乙=![]() ≈3.702,甲容器中达到平衡状态时,c(CO)=c(H2)=1.5 mol/L,c(H2O)=2 mol/L-1.5 mol/L=0.5 mol/L,化学平衡常数K甲=
≈3.702,甲容器中达到平衡状态时,c(CO)=c(H2)=1.5 mol/L,c(H2O)=2 mol/L-1.5 mol/L=0.5 mol/L,化学平衡常数K甲=![]() =4.5,该反应的正反应是吸热反应,升高温度平衡正向移动,化学平衡常数增大,所以K甲大于K乙,说明甲温度高于乙,T2<T1,B错误;
=4.5,该反应的正反应是吸热反应,升高温度平衡正向移动,化学平衡常数增大,所以K甲大于K乙,说明甲温度高于乙,T2<T1,B错误;
C. 根据选项B分析可知,温度为T1时,反应的平衡常数为K=4.5,C错误;
D. 达到平衡状态时,丙中c(CO)=3mol/L,根据方程式可知c(H2)=c(CO)=3 mol/L,温度不变化学平衡常数不变,则平衡时c(H2O)=![]() mol/L=2 mol/L,反应产生的CO的物质的量n(CO)=c·V=3 mol/L×V=3V mol,反应消耗的水的物质的量等于生成的CO的物质的量,所以反应开始时水的物质的量为2V mol+3V mol=4 mol,解得V=0.8 L,D正确;
mol/L=2 mol/L,反应产生的CO的物质的量n(CO)=c·V=3 mol/L×V=3V mol,反应消耗的水的物质的量等于生成的CO的物质的量,所以反应开始时水的物质的量为2V mol+3V mol=4 mol,解得V=0.8 L,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
k | 1.67 | 1.11 | 1.00 | 0.60 |
下列有关叙述不正确的是
A. 该反应平衡常数表达式为K=[c(CO2)·c(H2)]/[c(CO)·c(H2O)]
B. 该反应的逆反应是吸热反应
C. 830℃时,向恒容密闭容器中加入CO2 和H2各1mol,当测得CO2 的物质的量为0.4mol时,反应处于平衡状态
D. 若某温度下该反应中各物质的平衡浓度符合关系式:[c(CO2)/3c(CO)]=[c(H2O)/5c(H2)],则该温度是1000 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol共价键所吸收的能量或形成1 mol共价键所释放的能量称为键能。已知:H—H键能为436 kJ/mol,H—N键能为391 kJ/mol,N2 (g)+ 3H2(g) ![]() 2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
A.H—H比N≡N更牢固
B.N≡N键能约为945.6 kJ/mol
C.合成氨反应选择适当的催化剂是为了提高H2的转化率
D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)市场上出售的“热敷袋”是利用原电池原理产生热量,主要成分是铁屑、碳粉和少量的NaCl、水等。“热敷袋”在启用前用塑料袋使之与空气隔绝;启用时打开塑料袋轻轻揉搓,就会放出热量,使用后,会发现袋内有许多铁锈生成。请回答:
①碳粉的作用是___________________,加入NaCl的作用是________________________。
②正极反应的方程式为______________________________________。
③写出使用后生成铁锈所发生的氧化还原反应的化学方程式______________________________________________________________________。
(2)一种既能供电又能固氮的新型氢氮燃料电池的工作原理如图所示:其中电解液为溶有化合物A的稀盐酸。回答下列问题:
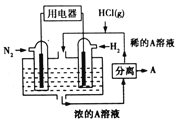
①电子从通入______(填“N2”或“H2”)的电极流出,化合物A为_________(填化学式)
②正极的电极方程式为________________________________。
③电路中通过2.4mol电子时,两极共消耗标准状况下的气体___________L。
④放电过程中电解质溶液的PH会_______(填“增大”或“减小””或“不变”),为维持电解质PH基本不变,可往溶液中通入________气体(填“NH3”或“HCl”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径,由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ/mol
CH3OH(g) △H3=-90.77kJ/mol
回答下列问题:
(1)反应Ⅱ的△H2=______ ,反应 I自发进行条件是 ______(填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下3 L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。
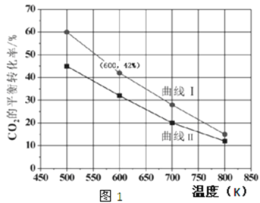
①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3 mol,n(CO2)=1.5 mol B:n(H2)=3 mol,n(CO2)=2 mol,
曲线 I代表哪种投入方式______(用A、B表示)。
②在温度为500K的条件下,按照A方式充入3 molH2和1.5 molCO2,该反应10 min时达到平衡:
a.此温度下的平衡常数为______;500K时,若在此容器中开始充入0.3 mol H2和0.9 molCO2、0.6 mol CH3OH、x mol H2O,若使反应在开始时正向进行,则x应满足的条件是 ______。
b.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3 min时,迅速将体系温度升至600 K,请在图2中画出3~10 min内容器中CH3OH浓度的变化趋势曲线__________。
(3)化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应,图3是甲醇燃料电池的模型。
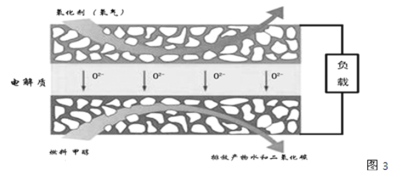
①写出该燃料电池的负极反应式 ______。
②如果用该电池作为电解装置,当有16 g甲醇发生反应时,则理论上提供的电量最多为 ______(法拉第常数为9.65×104C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000 mol/L NaOH溶液滴定未知浓度的盐酸溶液,操作可分解为如下几步:
A.用蒸馏水洗干净滴定管;B. 用待测定的溶液润洗酸式滴定管;C.用酸式滴定管取稀盐酸20.00 mL,注入锥形瓶中,加入酚酞;D.另取锥形瓶,再重复操作一次;E.检查滴定管是否漏水;F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________。
(2)操作F中应该选择图中________滴定管(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应观察________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是____________________________。
(4)滴定结果如表所示:
滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20 | 1.02 | 21.03 |
2 | 20 | 2.00 | 25.00 |
3 | 20 | 0.60 | 20.60 |
滴定中误差较大的是第________次实验,造成这种误差的可能原因是________。
A. 碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B. 滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C. 滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D. 达到滴定终点时,仰视溶液凹液面最低点读数
E. 滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为________mol/L。
(6)如果准确移取20.00 mL 0.1000 mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是( )
A.由反应可确定:氧化性:HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4Cl2+I2+6H2O═12H++8Cl-+2IO3-
C.若氯酸分解所得混合气体,1 mol混合气体质量为47.6 g,则反应方程式可表示为26HClO3 ═15O2↑+8Cl2↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 中不断滴入
中不断滴入![]() ,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是
,混合溶液pH变化如图所示。此过程溶液下列说法不正确的是![]() 已知:
已知:![]() 时一元酸
时一元酸![]() 电离平衡常数
电离平衡常数![]()
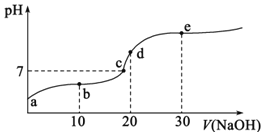
A.a点溶液的pH大于3
B.b点溶液中离子:![]()
C.c点表示酸![]() 和
和![]() 溶液恰好完全反应
溶液恰好完全反应
D.d点溶液加水稀释后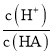 的值会增大
的值会增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com