
����Ŀ����һ�������£���A��B��0.32 mol����10 L�ĺ����ܱ������У��������·�Ӧ��A(s)+B(g)![]() 2C(g) ��H<0����Ӧ�����вⶨ�����������������˵����ȷ����
2C(g) ��H<0����Ӧ�����вⶨ�����������������˵����ȷ����
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.��Ӧǰ2 min��ƽ����Ӧ����v(C)=0.004 mol/(L��min)
B.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��v(��)>v(��)
C.�����������䣬��ʼʱ�������г����0.64 mol��A��B��ƽ��ʱn(C)<0.48 mol
D.�����������䣬��ƽ����ϵ���ٳ���0.32 mol B��0.16 mol C���ٴﵽƽ��ʱ��A��ת��������
���𰸡�C
��������
A��ǰ2min������n(B)=(0.32-0.24) mol=0.08 mol�����ݷ���ʽ֪��ǰ2 min�����ɵ�n(C)=2n(B)(����)=0.16 mol��v(C)=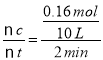 =0.008 mol/(L��min)��A����
=0.008 mol/(L��min)��A����
B���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ�����v(��)<v(��)��B����
C�������������䣬��ʼʱ�������г����0.64 molA��B����Ӧ��Ũ����ԭ����2�����൱������ѹǿ������ѹǿ����ѧƽ�������ƶ�������ƽ��ʱ���ɵ�C���ʵ���С��ԭ��2������һ�δﵽƽ��״̬ʱn(C)=2n(B)(����)=2��(0.32-0.20) mol=0.24 mol���ڶ��μ���A��Bʱ��Ӧ�ﵽƽ��״̬ʱn(C)<0.24 mol��2=0.48 mol��C��ȷ��
D�������������䣬ԭ���ﵽƽ��״̬��c(B)=![]() =0.02 mol/L��c(C)=
=0.02 mol/L��c(C)=![]() =0.024mol/L�����Դ�ʱ�Ļ�ѧƽ�ⳣ��K=
=0.024mol/L�����Դ�ʱ�Ļ�ѧƽ�ⳣ��K=![]() =0.0288���¶Ȳ���ƽ�ⳣ�����䣬��ƽ����ϵ���ٳ���0.32 mol B��0.l6 mol C����ʱc(B)=0.02 mol/L+
=0.0288���¶Ȳ���ƽ�ⳣ�����䣬��ƽ����ϵ���ٳ���0.32 mol B��0.l6 mol C����ʱc(B)=0.02 mol/L+![]() =0.052mol/L��c(C)= 0.024mol/L+
=0.052mol/L��c(C)= 0.024mol/L+![]() =0.04mol/L��Ũ����=
=0.04mol/L��Ũ����=![]() ��0.031>K��ƽ�������ƶ����ٴδﵽƽ��״̬ʹA��ת���ʽ��ͣ�D����
��0.031>K��ƽ�������ƶ����ٴδﵽƽ��״̬ʹA��ת���ʽ��ͣ�D����
�ʺ���ѡ����C��


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Ҫ�Ļ�ԭ������֪���з�Ӧ���Ȼ�ѧ����ʽ�����й��ڷ�Ӧ���ʱ��ж���ȷ����
2H2(g)+O2(g)===2H2O(g) ��H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) ��H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) ��H3
2Al(s)+3/2O2(g)===Al2O3(s) ��H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) ��H5
A. ��H1<0����H3>0 B. ��H5<0����H4<��H3
C. ��H1=��H2+��H3 D. ��H3=��H4+��H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��![]() ��ɫ
��ɫ![]() ��ˮ�лᲿ��ת��Ϊ
��ˮ�лᲿ��ת��Ϊ![]() ��ɫ
��ɫ![]() ���ù��̿������ӷ�Ӧ��ʽ��ʾΪ�� ______ ����
���ù��̿������ӷ�Ӧ��ʽ��ʾΪ�� ______ ����![]() ��Һ�м���������NaOH��Һ����Һ��ɫ����ȫ��ɻ�ɫ���ù��̿��û�ѧ��Ӧ��ʽ��ʾΪ�� ______ ��
��Һ�м���������NaOH��Һ����Һ��ɫ����ȫ��ɻ�ɫ���ù��̿��û�ѧ��Ӧ��ʽ��ʾΪ�� ______ ��
��2��ˮ�ϲ��ᾧ�����ɿɱ�ʾΪ![]() ��Ϊ�ⶨx��ֵ����������ʵ�飺
��Ϊ�ⶨx��ֵ����������ʵ�飺
�ٳ�ȡWg�����ᾧ�壬�������Ƴ�100mLˮ��ҺΪ����Һ��
��ȡ25mL����Һ������ƿ�У��ټ���������ϡ![]() ��
��
����Ũ��Ϊa![]() ��
��![]() ����Һ���еζ�
����Һ���еζ�![]() �ζ���������
���������![]() ��
��![]() ����
����![]() ��
��
��ش𣺢�д���ζ�ʱ�����ķ�Ӧ�����ӷ���ʽΪ�� ______ ��
�ڵζ�ʱ����![]() ��Һװ�� ______ ʽ�ζ����У�
��Һװ�� ______ ʽ�ζ����У�
�ۼ���ζ��յ�ʱ����ȥVmL![]() ��Һ������������Һ�����ʵ���Ũ��Ϊ ______
��Һ������������Һ�����ʵ���Ũ��Ϊ ______ ![]() ��
��
��������ʵ���У����в���![]() ����������ȷ
����������ȷ![]() ����ɲⶨ���xֵƫ�ߵ��� ______
����ɲⶨ���xֵƫ�ߵ��� ______ ![]() ����ĸ
����ĸ![]() ��
��
A���ζ��յ����ʱ���Ӷ���B����ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ñ�Һ��ϴ
C����ƿˮϴ�����ô���Һ��ϴD���ζ�ʱ���õ�![]() ��Һ����ö�����Ũ�ȱ�С��
��Һ����ö�����Ũ�ȱ�С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�����У���ȷ����
A. �Ȼ�����ӵ��γɹ��̿��õ���ʽ��ʾΪ��![]()
B. 16O�� 18O���������ͺ�������Ų�����ͬ
C. �ȶ��ԣ�CH4��SiH4����ԭ�ԣ�HCl��H2S
D. K����Ca2����Mg2�������Ӱ뾶���μ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:��ӦCO(g)+H2O(g)![]() CO2(g)+H2(g)�ڲ�ͬ���¶��µ�ƽ�ⳣ���ֱ�Ϊ:
CO2(g)+H2(g)�ڲ�ͬ���¶��µ�ƽ�ⳣ���ֱ�Ϊ:
t/�� | 700 | 800 | 830 | 1000 | 1200 |
k | 1.67 | 1.11 | 1.00 | 0.60 |
�����й���������ȷ����
A. �÷�Ӧƽ�ⳣ������ʽΪK=[c(CO2)��c(H2)]/[c(CO)��c(H2O)]
B. �÷�Ӧ���淴Ӧ�����ȷ�Ӧ
C. 830��ʱ��������ܱ������м���CO2 ��H2��1mol�������CO2 �����ʵ���Ϊ0.4molʱ����Ӧ����ƽ��״̬
D. ��ij�¶��¸÷�Ӧ�и����ʵ�ƽ��Ũ�ȷ��Ϲ�ϵʽ:[c(CO2)/3c(CO)]��[c(H2O)/5c(H2)]������¶���1000 C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�ǻ�ѧʵ������������л����Ҵ��������ƾ�����������ˮ����������ζ���ܽ�����ͼ��ʾ�Ķ��ַ�Ӧ��
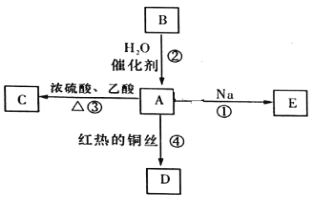
��1��д��D�ķ���ʽ_____________________��
��2��������Ӧ��ʱ����____________________��������Һ����������Һ��ײ�������
��3��д����Ӧ�۵ķ�Ӧ����___________��
��4�����й��ڻ�����B�Ļ�ѧ���ʣ�˵����ȷ����__________������ĸ����
A��������B������Cl2����ȡ����Ӧ
B��������B������Cl2�����ӳɷ�Ӧ
C��������B����ʹ������Ȼ�̼��Һ��ɫ
D��������B������ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 mol���ۼ������յ��������γ�1 mol���ۼ����ͷŵ�������Ϊ���ܡ���֪��H��H����Ϊ436 kJ/mol��H��N����Ϊ391 kJ/mol��N2 (g)+ 3H2(g) ![]() 2NH3(g) ��H=92.4 kJ/mol������˵������ȷ����( )
2NH3(g) ��H=92.4 kJ/mol������˵������ȷ����( )
A.H��H��N��N���ι�
B.N��N����ԼΪ945.6 kJ/mol
C.�ϳɰ���Ӧѡ���ʵ��Ĵ�����Ϊ�����H2��ת����
D.0.5 mol N2��1.5 mol H2����������³�ַ�Ӧ���ų�����Ϊ46.2 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊ�������л�������Ʒ�ͻ�������ȼ�Ͼ��й�����Ӧ��ǰ����CO2����ϳɼ״��Ǻ�������CO2����Ч;������CO2�Ʊ��״����̿����漰��Ӧ���£�
��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ/mol
CH3OH(g)+H2O(g) ��H1=-49.58kJ/mol
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ/mol
CH3OH(g) ��H3=-90.77kJ/mol
�ش��������⣺
(1)��Ӧ�����H2=______ ����Ӧ I�Է����������� ______(�����ϵ����������ϸ����������κ��¶���)��
(2)��һ��������3 L�����ܱ������У�����һ������H2��CO2��������Ӧ��ʵ���÷�Ӧ���ڲ�ͬ��ʼͶ�����£���Ӧ��ϵ��CO2��ƽ��ת�������¶ȵĹ�ϵ���ߣ���ͼ1��ʾ��
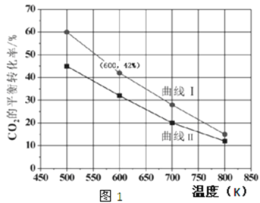
��H2��CO2����ʼ��Ͷ������A��B���ַ�ʽͶ��
A��n(H2)=3 mol��n(CO2)=1.5 mol B��n(H2)=3 mol��n(CO2)=2 mol��
���� I��������Ͷ�뷽ʽ______(��A��B��ʾ)��
�����¶�Ϊ500K�������£�����A��ʽ����3 molH2��1.5 molCO2���÷�Ӧ10 minʱ�ﵽƽ�⣺
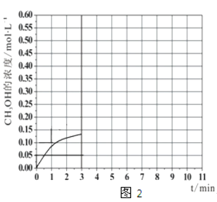
a.���¶��µ�ƽ�ⳣ��Ϊ______��500Kʱ�����ڴ������п�ʼ����0.3 mol H2��0.9 molCO2��0.6 mol CH3OH��x mol H2O����ʹ��Ӧ�ڿ�ʼʱ������У���xӦ����������� ______��
b.�ڴ������£�ϵͳ��CH3OH��Ũ���淴Ӧʱ��ı仯������ͼ2��ʾ������Ӧʱ��ﵽ3 minʱ��Ѹ�ٽ���ϵ�¶�����600 K������ͼ2�л���3��10 min��������CH3OHŨ�ȵı仯��������__________��
(3)����ȼ�ϵ����һ�����͵�ȼ�ϵ�أ������Թ��������������Ϊ����ʣ����ֹ��������ڸ���������������(O2-)�����ͨ�����õ�صĹ���ԭ����ͼ3��ʾ�����ж�缫��������缫��Ӧ��ͼ3�Ǽ״�ȼ�ϵ�ص�ģ�͡�
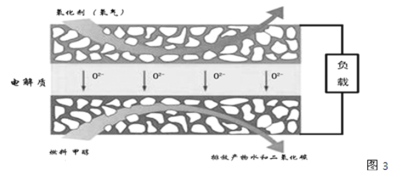
��д����ȼ�ϵ�صĸ�����Ӧʽ ______��
������øõ����Ϊ���װ�ã�����16 g�״�������Ӧʱ�����������ṩ�ĵ������Ϊ ______(�����ڳ���Ϊ9.65��104C/mol)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ������ʵ���ҽ��а��������Ʊ�������̽��ʵ������װ�ã����̶ֹ�װ��δ������
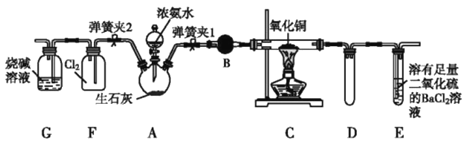
(1)����װ��װ�ú���Ҫ����A~Eװ�õ������ԣ�������ǣ�����______________�����ɼ�1����E��װ��ˮ��Ȼ����A���۲쵽E��������ð�����ƿ��ƾ��ƣ�E�е�����ˮ���γɣ�˵��װ�����������á�
(2)װ��B��ʢ�ŵ��Լ���______________________��
(3)��ȼC���ƾ��ƣ��رյ��ɼ�2�����ɼ�1���ӷ�Һ©���ų�Ũ��ˮ����û��ƿ�й���رշ�Һ©���������Ե�Ƭ�̣�װ��C�к�ɫ������죬װ��E����Һ����ִ������ݣ�ͬʱ����_____________(������)����E���ݳ�Һ����������ֱ�����������д��C�з�Ӧ�Ļ�ѧ����ʽ��_______��
(4)��C�й���ȫ�����ɫ�رյ��ɼ�1�������ƿ��ƾ��ƣ�����ȴ����C�й�������������Ӧǰ��������Ϊ16 g����Ӧ�������������2.4 g��ͨ������ȷ���ù������Ļ�ѧʽ��______��
(5)�ڹرյ��ɼ�1���ɼ�2�������������F�У��ܿ췢��װ��F�в������̣�ͬʱ����G����ҺѸ�ٵ�������F�С�д���������̵Ļ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com