
【题目】最近几年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如1图所示.据此判断:
2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如1图所示.据此判断: 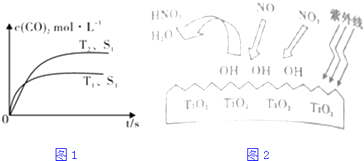
①该反应的△H0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线 .
③研究表明在紫外线照射下,由于TiO2的催化作用,空气中的某些物质会产生OH自由基,如图2所示,OH与NO2反应为NO2+OH=HNO3 , 写出NO与OH反应的化学方程式
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.NH3与CO2在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)(NH2)2CO(s)+H2O(g).现将物质的量为1:1的NH3与CO2混合在密闭固体容器中反应,平衡后,NH3的体积分数为20%,则NH3的平衡转化率为 .
③25℃时,将amolL﹣1的氨水与b molL﹣1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3H2O的电离平衡常数为 .
【答案】
(1)<; ;NO+3OH═HNO3+H2O
;NO+3OH═HNO3+H2O
(2)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=﹣898.1kJ/mol;75%;![]()
【解析】解:(1)①由图可知,温度T1先到达平衡,故温度T1>T2 , 温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,所以答案是:<;②若催化剂的表面积S1>S2 , 由增大其表面积可提高化学反应速率,故T2、S2条件下到达平衡时间比T2、S1的时间更长,但不影响化学平衡移动,平衡时二氧化碳的浓度不变,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线为:  ;
;
所以答案是:  ;③由图象可知NO、NO2均被OH氧化为HNO3,由原子守恒,NO+3OH═HNO3+H2O;所以答案是:NO+3OH═HNO3+H2O;(2)①已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
;③由图象可知NO、NO2均被OH氧化为HNO3,由原子守恒,NO+3OH═HNO3+H2O;所以答案是:NO+3OH═HNO3+H2O;(2)①已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
②2NO2(g)N2O4(g)△H=﹣56.9kJ/mol
③H2O(g)=H2O(l)△H=﹣44kJ/mol
根据盖斯定律:①﹣②+③×2可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=﹣898.1kJ/mol;
所以答案是:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=﹣898.1kJ/mol;②NH3与CO2物质的量为1:1,设起始量均为1 mol,NH3的平衡转化率为x,根据三段式:
CO2(g)+ | 2NH3(g) | (NH2)2CO(s)+ | H2O(g) | ||
起始量(mol): | 1 | 1 | 0 | 0 | |
转化量(mol): | 0.5x | x | 0.5x | 0.5x | |
平衡量(mol): | 1﹣0.5x | 1﹣x | 0.5x | 0.5x |
NH3的体积分数为20%,则有 ![]() =20%,解得x=75%;
=20%,解得x=75%;
所以答案是:75%;③根据电荷守恒有c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),由于溶液呈中性,则c(H+)=c(OH﹣)10﹣7mol/L,故c(NH4+)=c(Cl﹣)= ![]() ×bmolL﹣1=0.5bmolL﹣1 , 故混合后溶液中c(NH3 . H2O)=
×bmolL﹣1=0.5bmolL﹣1 , 故混合后溶液中c(NH3 . H2O)= ![]() ×amolL﹣1﹣0.5bmolL﹣1=(0.5a﹣0.5b)mol/L,NH3H2O的电离常数Kb=
×amolL﹣1﹣0.5bmolL﹣1=(0.5a﹣0.5b)mol/L,NH3H2O的电离常数Kb= ![]() =
= ![]() =
= ![]() ;
;
所以答案是: ![]() .
.
【考点精析】掌握反应热和焓变和化学平衡的计算是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应.下列说法中,正确的是( )
A.达到化学平衡时,正反应速率与逆反应速率不相等
B.反应过程中,Y的单质的体积分数始终为50%
C.达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1
D.达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新一代锂电池的反应为:FePO4+Li ![]() LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
A.放电时电池正极反应为:FePO4+Li++e﹣═LiFePO4
B.充电时LiFePO4只发生氧化反应不发生还原反应
C.充电过程中,电池正极材料的质量增加
D.加入硫酸可以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁易被氧化而变质.为检验某补血剂中硫酸亚铁是否变质,可向该补血剂配成的溶液中加入( )
A.AgNO3溶液
B.盐酸酸化的BaCl2溶液
C.KSCN溶液
D.HNO3酸化的Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池广泛用于各种电子仪器的电源,它的充放电过程可表示为:2Ag+Zn(OH)2![]() Ag2O+Zn+H2O回答下列有关问题.
Ag2O+Zn+H2O回答下列有关问题.
(1)电池的放电过程是(填“①”或“②”).
(2)该电池属于性电池(填“酸”、“碱”或“中”).
(3)写出充电时阳极的电极反应式:
(4)充电时,电池的正极应接电源的极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C均为短周期元素形成的单质,且元素A、B同周期,A元素原子半径大于B元素原子半径,在一定条件下单质A和单质B、单质A和C都按物质的量2:1反应,分别生成X和Y,在产物中B、C两元素呈负价. 分别取3份完全相同且质量均为1.52g由单质A和单质B组成的混和物进行下列实验:
①在第一份样品中加入过量盐酸,充分搅拌后在标准状况下放出0.896L H2 , 残留不溶于酸的固体0.56g
②在第二份样品中加入过量浓NaOH溶液,微热充分反应后在标准状况下放出0.896L H2残留不溶于碱的固体0.96g
③将第三份样品隔绝空气加强热生成化合物X,将X投入稀盐酸中,X溶解且放出在空气中能自燃的气体a L
根据上述题给信息和实验记录解答下列问题
(1)写出下列元素的名称:A:;C:;
(2)混和物中B的质量分数是:
(3)计算:a= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、W、X、Y、Z在元素周期表中的对应位置如图所示,其中只有Z为金属元素.下列说法正确的是( ) 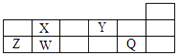
A.W、X两元素在自然界中都存在相应的单质
B.Q、Y分别与钠元素形成的化合物中仅含离子键
C.简单离子半径由大到小的顺序为:Q>Y>Z
D.X、Z的最高价氧化物对应的水化物之间易发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com