
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.pH=2的溶液:Na+、Fe3+、Cl-、NO3-
B.c(NaAlO2)=0.1mol·L-1的溶液:K+、H+、Cl-、SO42-
C.c(OH)<![]() 的溶液:Na+、K+、SiO32-、ClO-
的溶液:Na+、K+、SiO32-、ClO-
D.c(Fe3+)=0.1mol·L-1的溶液:Al3+、NO3-、MnO4-、SCN-
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予借助某些金属离子制造出复杂新分子,从而合成分子机器的三位科学家,合成新分子过程模拟如下:

下列有关信息错误的是( )
A.图中新月形分子和环状分子“组合”在一起,铜离子起关键作用
B.利用此方式可以合成新分子,同时也可能创造一种全新“机械键”
C.在创造新分子技术中,铜离子不是唯一可以借助的金属离子
D.此技术不可以“互锁”合成![]() 分子,甚至成更复杂的分子
分子,甚至成更复杂的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯稍有水果气味,用于配制香水香精和人造精油,也大量用于食品中,实验室制备方法如下:

Ⅰ苯甲酸乙酯粗产品的制备
在干燥的50 mL三颈圆底烧瓶中,加入6.1g苯甲酸、过量无水乙醇、8 mL苯和1mL浓硫酸,摇匀后加沸石,安装分水器。水浴加热,开始控制回流速度1~2 d/s。反应时苯一乙醇﹣水会形成“共沸物”蒸馏出来。加热回流约1小时,至分水器中不再有小水珠生成时,停止加热。改为蒸馏装置,蒸出过量乙醇和苯。
沸点(℃) | 相对分子质量 | |
苯甲酸 | 249 | 122 |
苯甲酸乙酯 | 212.6 | 150 |
(1)写出苯甲酸与用18O标记的乙醇酯化反应的方程式___________________。
(2)装置A的名称及冷水通入口_________________________。
(3)通过分水器不断分离除去反应生成的水,目的是___________________。还有什么方法可以实现同样的目的_____________(任答两种)。
(4)实验过程中没有加沸石,请写出补加沸石的操作___________________。
(5)图二装置中的错误______________________。
Ⅱ.苯甲酸乙酯的精制
将苯甲酸乙酯粗产品用如下方法进行精制:将烧瓶中的液体倒入盛有30 mL冷水的烧杯中,搅拌下分批加入饱和Na2CO3溶液(或研细的粉末),至无气体产生,pH试纸检测下层溶液呈中性。用分液漏斗分出粗产物,水层用乙醚(10 mL)萃取。合并有机相,用无水CaCl2干燥。干燥后的粗产物先用水浴蒸除乙醚,再改用减压蒸馏,收集馏分。
(6)加入饱和碳酸钠溶液除了可以降低苯甲酸乙酯溶解度外,还有的作用是__________。
(7)按照纠正后的操作进行,测得产品体积为5mL(苯甲酸乙酯密度为1.05gcm﹣3)。实验的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素在生产、生活中有重要用途。回答下列问题:
(1)三聚磷酸钠(俗称“五钠”常用于食品生产中,作水分保持剂、品质改良剂等。
①磷酸的结构式如图所示,其主要的电离方程式为______________。
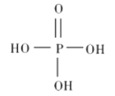
②三聚磷酸是三分子磷酸脱去两分子水后的产物,三聚磷酸钠的化学式为_______________。
(2)在碱性条件下,次磷酸盐(H2PO2-)可用于化学镀银,写出其反应的离子方程式______________。(氧化产物与还原产物物质的量之比为1:4)
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
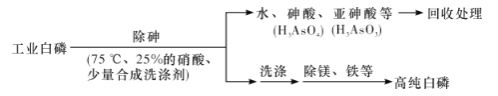
①除砷过程在75 ℃下进行,其合理的原因是____________(填字母代号)。
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率
②硝酸氧化除砷时被还原为NO,写出砷转化为亚砷酸的化学方程式:______________________________。
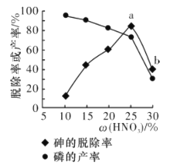
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是__________________。
(4)常温下银氨溶液中存在平衡:Ag+(aq) + 2NH3(aq) ![]() Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷(Clopidogrel)是一种用于抑制血小板聚集的药物。以A为原料合成氯吡格雷的路线如下:
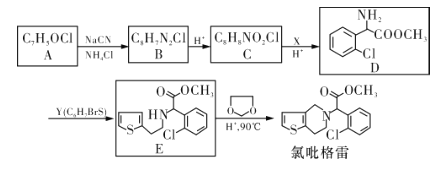
已知: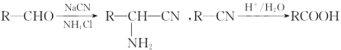 。
。
请回答下列问题:
(1)A中含氧官能团的名称为___________,C→D的反应类型是_____________。
(2)Y的结构简式为___________,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有_______种。
(3)C分子间可在一定条件下反应生成含有3个六元环的产物,该反应的化学方程式为_________________________________。
(4)由E转化为氯吡格雷时,生成的另一种产物的结构简式为_______________。
(5)写出A的所有同分异构体(芳香族化合物)的结构简式:___________________(只有一个环、不考虑立体异构)。
(6)请结合题中信息写出以![]() 为有机原料制备化合物
为有机原料制备化合物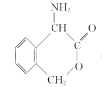 的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:
的合成路线流程图(无机试剂任选)。______________________________________________。合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1 mol·L-1 NaOH溶液中加入0.1mol·L-1的一元酸HA,测得溶液pH的变化曲线如图所示,下列说法正确的是
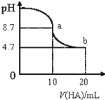
A.a点所示溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
B.b点所示溶液中c(A-)>c(HA)
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.a、b两点所示溶液中水的电离程度a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比。当电解装置插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是( )
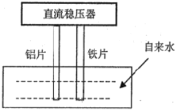
A.通电时,铝片做阳极,铁片做阴极
B.生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C.通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D.铁片的电极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CO(g)+3H2(g)![]() CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
写出CO与H2O (g)反应生成H2和CO2的热化学方程式____________________________________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是______________。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_______________,此反应的平衡常数为__________________(结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是____________。
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)![]() CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1
①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处____________。
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。

(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com