
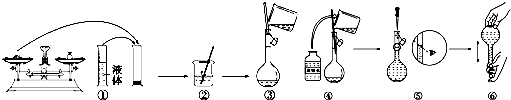
| n |
| V |


科目:高中化学 来源: 题型:
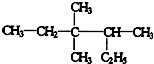
 ,
,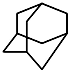 .的分子式为
.的分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4和H3PO4的摩尔质量相等 |
| B、在标准状况下18g水的体积约为22.4L |
| C、1molH2所占的体积约为22.4L |
| D、通常状况下,NA个 CO2分子占有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
| 0.12 | 0.06 | 0.10 | t1 |
| 0.06 | 0.12 | 0.20 | t2 |
A、0~t1时间段内,平均反应速率v(B)=
| ||
B、若起始时n(D)=0,则t2时v(D)=
| ||
| C、升高温度,v(B)、vC)、v(D)均增大 | ||
| D、b:d=6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、②③④ | C、只有④ | D、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若溶液中部分粒子间满足:c(CH3COO-)=c(Na+) 则该溶液一定呈中性 |
| B、溶液中四种离子之间不可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、若溶液中粒子间满足:c(CH3COO-)>c( Na+)>c(H+)>c(OH-),则溶液中溶质一定是CH3COONa和CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中可能含K+ |
| B、该溶液中肯定含有NO3?、SO42-、NH4+、CO32- |
| C、该溶液中一定不含NH4+ |
| D、该溶液中一定含K+,且c(K+)≥0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
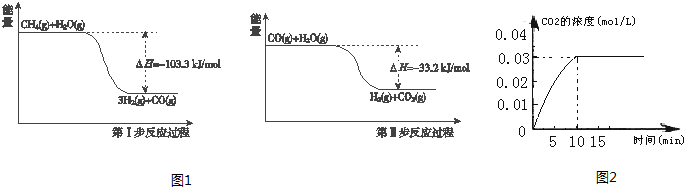
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com