


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
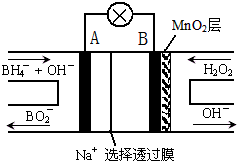
| A、电极B为正极 |
| B、放电过程中,Na+从正极区向负极区迁移 |
| C、电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物 |
| B、Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同 |
| C、乙醇分子中含羟基,可与金属钠反应生成氢气 |
| D、MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y、Z、W能形成含有相同电子数的简单离子,且W形成的简单离子的半径最大 |
| B、XZ2、W2Z2均为直线形的共价化合物 |
| C、Z与M形成的3原子化合物比Y的M形成的4原子化合物稳定 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、混合液中:c(H+)≤
| ||
| B、混合液中:c(NH3H2O)+c(NH4+)=0.5a mol?L-1 | ||
| C、a=b | ||
| D、混合液中,c(H+)+c(NH4+)=c(OH-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com