
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
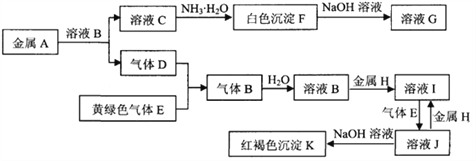
(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:________________________________________________________________
(5)检验溶液I中阳离子的方法是:__________________________
【答案】 氯化氢 偏铝酸钠 Al(OH)3+NaOH=NaAlO2+2H2O 2Fe3++Fe=3Fe2+ 加入足量的铁粉(过滤) 取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。
【解析】C中加氨水生成白色沉淀F,F可溶于NaOH溶液中,可知F为Al(OH )3,则C中含有Al3+,从而A为Al。E为Cl2,D为气体且与Cl2反应生成另一种气体B,可推测B为HCl。验证可知B确为HCl。由红褐色沉淀K可知K为Fe(OH)3,所以H为Fe。
(1)由上面分析可知B是氯化氢、F为Al(OH )3,与NaOH反应生成Na2AlO2,G的名称为偏铝酸钠。
(2)Al(OH )3与NaOH反应生成Na2AlO2和H2O,化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O。
(3)金属H为Fe,B为HCl,所以I为FeCl2,J为 FeCl3,J→I的离子方程式为:2Fe3++Fe=3Fe2+。
(4)FeCl2溶液中混有FeCl3,可加入足量的Fe粉使Fe3+转化为Fe2+,然后过滤。
(5)检验FeCl2中Fe2+的方法:取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。


科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的浓度关系正确的是( )
A.c(NH ![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
C.1.0 mol/L Na2CO3溶液:c(OH﹣)=c(HCO ![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HA﹣)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( ) 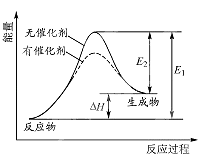
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法不正确的是( )
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. 屠呦呦提取青蒿素加入乙醚萃取,此过程属于化学变化
D. “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.用金属钠可区分乙醇和乙醚
B.用高锰酸钾酸性溶液可区分己烷和3﹣己烯
C.用水可区分苯和溴苯
D.用新制的银氨溶液可区分甲酸甲酯和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序:c(Cl﹣)>c(NH ![]() )>c(H+)=c(OH﹣)
)>c(H+)=c(OH﹣)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( ) ①Na+、Fe2+、H+、NO ![]() ②K+、NH
②K+、NH ![]() 、HCO
、HCO ![]() 、OH﹣
、OH﹣
③S2﹣、SO ![]() 、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO
、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO ![]()
⑤K+、Na+、AlO ![]() 、HCO
、HCO ![]() ⑥Ca2+、Na+、SO
⑥Ca2+、Na+、SO ![]() 、CO
、CO ![]() .
.
A.①⑥
B.③
C.②⑤
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
(1)Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应最慢.
(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: , .
(3)Ⅱ.利用如图装置可以验证非金属性的变化规律.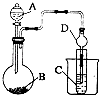
仪器A的名称为 , 干燥管D的作用是 .
(4)实验室中现有药吕Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫;装置A、B、C中所装药品分别为、、 . 装置C中实验现象为有淡黄色沉淀生成,离子方程式为 .
(5)若要证明非金属性:C>Si,则A中 , B中加Na2CO3、C中加 , 观察到C中溶液的现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法正确的是( )
A.在正极上发生氧化反应
B.化学性质较活泼的金属为负极
C.在外电路,电子流出正极
D.是由电能转化为化学能的装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com