
下列物质含有离子键的是
A.Cl2 B.NaCl C.CO2 D.H2O
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
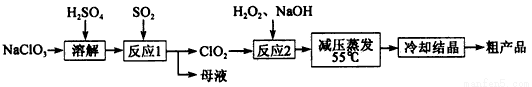
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:计算题
(12分)接触法制硫酸采用V2O5作催化剂,使用过的催化剂中含V2O5、VOSO4和SiO2,其中VOSO4能溶于水,从使用过的V2O5催化剂中回收V2O5的主要步骤是:向使用过的催化剂中加硫酸和Na2SO3浸取还原,过滤得VOSO4溶液;向滤液中加入KClO3氧化,再加入氨水生成沉淀;将沉淀焙烧处理后得V2O5。
(1) V2O5被浸取还原的反应产物之一是VOSO4,该反应的化学方程式为____。
(2) 若生产过程使用的硫酸用量过大,进一步处理时会增加________的用量。氨气常用________检验,现象是________________________。
(3) 若取加入氨水后生成的沉淀(其摩尔质量为598 g·mol-1,且仅含有四种元素)59.8 g充分焙烧,得到固体残留物54.6 g,同时将产生的气体通过足量碱石灰,气体减少了1.8 g,剩余的气体再通入稀硫酸则被完全吸收。通过计算确定沉淀的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
化学与生活、生产、环境等社会实际密切相关。下列叙述正确的是( )
A.稀的食盐水能杀死H7N9禽流感病毒
B.涤纶、塑料、光导纤维都是有机高分子材料
C.用电镀厂的废水直接灌溉农田,可提高水的利用率
D.外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是
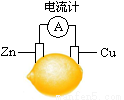
A.将电能转化为化学能
B.电子由铜片流出
C.锌片是负极.
D.铜片逐渐被腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成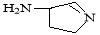 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
(6)铜的某氯化物的晶胞结构如图所示,该化合物的化学式为 。
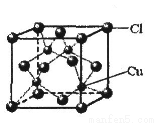
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3 、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高一下学期期中考试化学试卷(解析版) 题型:填空题
(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
a |
|
| |||||
|
|
| b | c | d |
|
|
e |
| f |
|
| g |
|
|
(1) f元素在周期表中的位置是第 周期第 族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_____________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.HClO的电子式: B.硫离子结构示意图:
B.硫离子结构示意图:
C.丙醛的结构简式:CH3CH2COH D.碳酸的电离方程式:H2CO3 2H++CO32-
2H++CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com