
【题目】下列叙述错误的是( )
A. 在铁件上镀铜时,金属铜作阳极
B. 电解精炼粗铜时,电解质CuSO4溶液加少量硫酸是抑制 CuSO4水解
C. 纯锌与稀硫酸反应时,加入少量CuSO4,可使反应速率加快
D. 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH﹣+6e﹣═CO2+5H2O
【答案】D
【解析】
A、电镀原理是镀层金属做阳极,待镀金属做阴极,电解质溶液中含镀层离子;
B、CuSO4在溶液中水解:Cu2++2H2O![]() Cu(OH)2+2H+,加少量硫酸,水解平衡向左移动,抑制 CuSO4水解;
Cu(OH)2+2H+,加少量硫酸,水解平衡向左移动,抑制 CuSO4水解;
C、锌和硫酸铜反应生成的铜,铜和锌在稀硫酸中形成原电池,反应加快反应速率;
D、甲醇燃料电池是碱性环境,甲醇在负极放电生成CO32-。
A项、电镀铜时,铜作阳极,阳极上铜失电子发生氧化反应,镀件作阴极,阴极上铜离子放电生成铜,故A正确;
B项、CuSO4在溶液中水解:Cu2++2H2O![]() Cu(OH)2+2H+,加少量硫酸,溶液中c(H+)增大,水解平衡向左移动,抑制 CuSO4水解,故B正确;
Cu(OH)2+2H+,加少量硫酸,溶液中c(H+)增大,水解平衡向左移动,抑制 CuSO4水解,故B正确;
C项、纯锌与稀硫酸反应时,加入少量CuSO4溶液,在锌表面析出铜,在稀硫酸中形成原电池反应,可使反应速率加快,故C正确;
D项、甲醇和氧气在KOH溶液中构成的新型燃料电池的反应为: 2CH3OH+3O2+4OH-→2CO32-+6H2O,负极上甲醇放电生成CO32-,电极反应式为:CH3OH+8OH-+6e-═CO32-+6H2O,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g)+I2(g)![]() 2HI(g)达到平衡状态时的标志是( )
2HI(g)达到平衡状态时的标志是( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ka(HF) = 3.6×10-4 ,Ksp(CaF2) = 1.46×10-10。现向1 L 0.2mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是( )
A. 25℃时,0.1 mol·L-1HF 溶液中pH=1 B. 该体系中HF与CaCl2反应产生沉淀
C. Ksp(CaF2)随温度和浓度的变化而变化 D. 加入CaCl2溶液后体系中的c(H+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下,下列说法正确的是( )

A. MgCO3与稀硫酸反应的离子方程式为CO32-+2H+=CO2↑+H2O
B. 加入H2O2氧化的离子方程式为Fe2+ + H2O2+2H+ =Fe3+ + 2H2O
C. 滤渣2的成分是Fe(OH)3 和Mg(OH)2
D. 流程图中过滤与煅烧之间有一系列的的实验操作,最后得到MgSO4·7H2O晶体,对MgSO4·7H2O晶体直接加热可以得到无水MgSO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应过程中体系的能量变化如图所示,下列说法错误的是
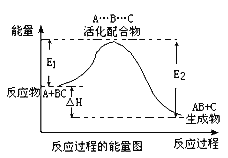
A. 该反应不一定能自发进行
B. E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C. 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D. 加入合适催化剂,△H不变,E1、E2也不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用密度为1.84g·mLˉ1、质量分数为98%的浓硫酸配制100mL3mol·Lˉ1稀硫酸。下列各步骤中操作正确的是( )
A.计算、量取:用10mL量筒量取16.3mL浓硫酸
B.溶解、稀释:将浓硫酸倒入烧杯,再倒入30mL左右的蒸馏水,搅拌,静置
C.转移、洗涤:待溶液冷却后,将溶液转移到容量瓶中,用蒸馏水洗涤烧杯和玻璃棒,洗涤液转入容量瓶,重复2~3次
D.定容、摇匀:加水至凹液面最低处与刻度线相切,摇匀,在容量瓶上贴上标签,注明溶液成分及浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com