
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,![]() 、
、![]() 是两块电极板,通过导线与直流电源相连。请回答下列问题:
是两块电极板,通过导线与直流电源相连。请回答下列问题:

(1)若![]() 、
、![]() 都是惰性电极,a是饱和
都是惰性电极,a是饱和![]() 溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中
溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中![]() 极现象为______,电极反应式为______,电解
极现象为______,电极反应式为______,电解![]() 溶液的离子方程式是______。
溶液的离子方程式是______。
(2)如要在铁上镀银,电解液选用硝酸银,则![]() 电极的材料是______,电极反应式是______。
电极的材料是______,电极反应式是______。
(3)若![]() 极为铜锌合金,
极为铜锌合金,![]() 极为纯铜,且电解质溶液中含有足量的
极为纯铜,且电解质溶液中含有足量的![]() ,通电一段时间后,若阳极恰好完全溶解,此时阴极质量增加7.68g,溶液质量增加0.03g,则合金中
,通电一段时间后,若阳极恰好完全溶解,此时阴极质量增加7.68g,溶液质量增加0.03g,则合金中![]() 、
、![]() 的物质的量之比为______。
的物质的量之比为______。
【答案】产生气泡,溶液变红 ![]()
![]() 铁
铁 ![]() 3:1
3:1
【解析】
(1)电解饱和![]() 溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子;
溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子;
(2)根据电镀银的工作原理知识来回答;
(3)先弄清两个电极的电极反应,再根据得失电子守恒计算。
(1)和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,氢离子浓度减小,氢氧根离子浓度增大,酚酞试液变红;和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即Cl--2e-=Cl2↑,所以电解![]() 溶液的离子方程式是2Cl-+2H2O
溶液的离子方程式是2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,
2OH-+H2↑+Cl2↑,
故答案为:产生气泡,溶液变红;2H++2e-=H2↑;2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)铁上电镀银,电解池的阴极材料是铁,电解液选用硝酸银,Ag+在阴极得电子被还原,电极反应式是Ag++e-=Ag,
故答案为:铁;Ag++e-=Ag;
(3)从装置中看Y电极是阳极,X电极是阴极,锌比铜活泼,优先铜放电,然后铜再放电。反应过程阳极:Zn-2e-=Zn2+,Cu-2e-=Cu2+, 阴极:Cu2++2e-=Cu
第一个阶段,溶液质量增加,第二阶段溶液质量不变;
设合金中铜锌的物质的量分别是x、y,所以由电子转移守恒可得:
65g/moly-64g/moly=0.03g
64g/mol(x+y)=7.68g,x=0.09mol,y=0.03mol,所以可得 ![]() = 3︰1 。
= 3︰1 。
故答案为:3:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室利用如图所示装置进行NaHCO3的受热分解实验。请回答:

(1)加热一段时间后,烧杯中观察到的实验现象是_________。
(2)实验结束时的正确操作是_____(填序号)否则会引起_______。
① 先将导管从液体中移出,再熄灭酒精灯
② 先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某另类元素周期表的一部分,下列说法正确的是( )

A. 简单阴离子的半径大小:X>Y>Z
B. 单质的氧化性:X>Y>Z
C. Y的氢化物只有一种
D. X的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:![]() ,下列说法错误的是
,下列说法错误的是
A. 电池工作时,锌失去电子
B. 用该电池电解水时,电子通过外电路流向电解池阳极
C. 电池正极电极反应式![]()
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将图1所示装置中的盐桥(琼脂-饱和![]() 溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是

A. 图1中,铁棒质量减少5.6g,则甲池![]() 溶液的质量增加5.6g
溶液的质量增加5.6g
B. 图1中的石墨电极与图2中乙池石墨![]() 电极的电极反应式相同
电极的电极反应式相同
C. 两图所示装置的能量变化均是将化学能转化为电能
D. 图2中电子流向为![]() 电流计→石墨a→石墨b→铜丝→石墨c→
电流计→石墨a→石墨b→铜丝→石墨c→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为
不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为![]()
![]()
![]() ,如图是高铁电池的模拟实验装置:
,如图是高铁电池的模拟实验装置:

①该电池盐桥中盛有饱和![]() 溶液,此盐桥中氯离子向______(填“左”或“右”)移动。
溶液,此盐桥中氯离子向______(填“左”或“右”)移动。
②该电池放电时正极的电极反应式为______;充电时每转移0.3mol电子,有______mol![]() 生成,正极附近溶液的碱性______(填“增强”,“不变”或“减弱”)。
生成,正极附近溶液的碱性______(填“增强”,“不变”或“减弱”)。

③上图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_________________。
(2)“![]() ”电池可将
”电池可将![]() 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“![]() ”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为
”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为![]()
![]()
![]() 。放电时该电池“吸入”
。放电时该电池“吸入”![]() ,其工作原理如图所示:
,其工作原理如图所示:

①充电时,正极的电极反应式为________________________________。
②放电时,若生成的![]() 和
和![]() 全部沉积在电极表面,当转移0.2mol
全部沉积在电极表面,当转移0.2mol![]() 时,两极的质量差为______。
时,两极的质量差为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种短周期元素A,B,C,D,已知:①C,D在同一周期,A,B在同一主族;②它们可以组成化合物A2C、B2C2、DC2、D2A4等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应生成气体A2,A2与气体C2按体积比2∶1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。请回答:
(1)写出元素符号:A________、B________、C________、D________。
(2)在A2C、B2C2、DC2和D2A4中,同时含有离子键和非极性共价键的化合物的电子式为__________;按原子轨道重叠方式,其非极性键的类型是________。化合物DC2的结构式__________。
(3)A2C分子的电子式____________,按原子轨道重叠方式,其共价键的类型是____________。D2A4是平面形分子,其分子中含有______个σ键,______个π键。
(4)写出化学方程式或离子方程式:
B2C2与A2C反应的化学方程式:___________________________________________;
B2C2与DC2反应的化学方程式:___________________________________________;
B与A2C反应的离子方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.碳酸钙与醋酸反应:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B.在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.用氨水吸收少量的二氧化硫:NH3·H2O+SO2=NH4++HSO3-
D.纯碱溶液中滴加少量硫酸,边加边振荡:2H++CO32-=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18-Ⅰ分子中只有两种不同化学环境的氢,且数目比为3:2的化合物(________)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
Ⅱ奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
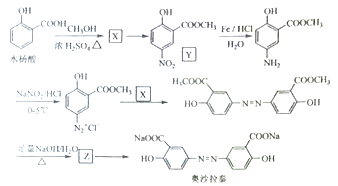
回答下列问题:
(1)X的结构简式为____;由水杨酸制备X的反应类型为_____。
(2)由X制备Y的反应试剂为_________。
(3)工业上常采用廉价的![]() ,与Z反应制备奥沙拉秦,通入的
,与Z反应制备奥沙拉秦,通入的![]() 与Z的物质的量之比至少应为____。
与Z的物质的量之比至少应为____。
(4)奥沙拉秦的分子式为______,其核磁共振氢谱为______组峰,峰面积比为______。
(5)若将奥沙拉秦用![]() 酸化后,分子中含氧官能团的名称为____。
酸化后,分子中含氧官能团的名称为____。
(6)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com