
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
 CuS↓+H2SO4不能发生
CuS↓+H2SO4不能发生科目:高中化学 来源:不详 题型:单选题
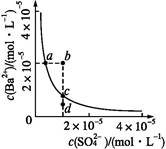
 Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.t°C时,Ag2CrO4的Ksp为1×10-8 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等 |
| D.t°C时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1 |
| C.因为H2SO4是强酸,故CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K= |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
| C.b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D.c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某离子被沉淀完全是指该离子在溶液中的浓度变为0 |
| B.某物质的溶解性为难溶,则该物质的溶解度为0 |
| C.一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物 |
| D.沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com